
【题目】绿矾(FeSO4·7H2O)可作还原剂、着色剂、制药等,在不同温度下易分解得到各种铁的氧化物和硫的氧化物。已知SO3是一种无色晶体,熔点16.8℃,沸点44.8℃,氧化性及脱水性强于浓硫酸,能漂白某些有机染料,如品红等。回答下列问题:
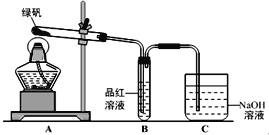
(1)甲组同学按照上图所示的装置,通过实验检验绿矾的分解产物。装置C的作用是_______________。装置B中可观察到的现象是__________________________,甲组同学由此得出绿矾的分解产物中含有SO2。
(2)乙组同学认为甲组同学的实验结论不严谨,认为需要补做实验。对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中______(填字母)。
A.不含SO2 B.可能含SO2 C.一定含有SO3
(3)丙组同学查阅资料发现绿矾受热分解还可能有O2放出,为此,丙组同学选用甲组同学的部分装置和下图部分装置设计出了一套检验绿矾分解所得气态产物的装置:
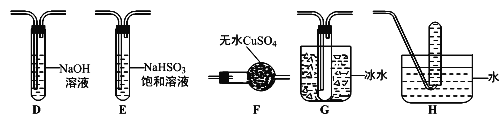
①丙组同学的实验装置中,依次连接的合理顺序为A→_________________→H。
②能证明绿矾分解产物中有O2的检验方法是________________________。
(4)为证明绿矾分解产物中含有三价铁的操作及现象__________________________。
【答案】吸收尾气,防止SO2(SO3)等气体扩散到空气中污染环境 品红溶液褪色 BC FGBD 用带火星的木条检验H中收集到的气体,木条复燃 取少量分解产物于试管中,加入足量稀盐酸溶解,再滴加几滴KSCN溶液,溶液变红色,说明有三价铁
【解析】
(1)二氧化硫能使品红溶液褪色,二氧化硫污染空气,不能直接排放至空气中;
(2)根据题意SO3氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红分析;
(3)检验绿矾分解气态产物,由A分解绿矾,经F干燥,二氧化硫三氧化硫均能漂白品红,故先检验三氧化硫并与二氧化硫分离,三氧化硫熔沸点低,故连接G装置冷凝三氧化硫,由装置B检验二氧化硫,经过装置D除去二氧化硫,连接装置H,收集氧气,利用氧气的助燃性检验氧气;
(4)根据三价铁离子使KSCN溶液显红色分析。
(1)甲组由此得出绿矾的分解产物中含有SO2,装置B为品红,二氧化硫有漂白性,故装置B中褪色;二氧化硫污染环境,用氢氧化钠吸收;
故答案为:吸收尾气,防止SO2(SO3)等气体扩散到空气中污染环境;品红溶液褪色;
(2)根据题意SO3氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红,三氧化硫的漂白不可恢复,乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中肯定有三氧化硫,未对二氧化硫检验,故可能含有二氧化硫;
故答案为:BC;
(3)①检验绿矾分解气态产物,由A分解绿矾,经F干燥,二氧化硫三氧化硫均能漂白品红,故先检验三氧化硫并与二氧化硫分离,三氧化硫熔沸点低,故连接G装置冷凝三氧化硫,由装置B检验二氧化硫,经过装置D除去二氧化硫,连接装置H,检验氧气;
故答案为:FGBD;
②氧气收集在H中,利用氧气支持燃烧检验,方法为:把H中的导管移出水面,撤走酒精灯,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;
故答案为:把H中的导管移出水面,撤走酒精灯,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;
(4)三价铁使KSCN溶液显红色,为证明绿矾分解产物中含有三价铁,则应用药匙取用分解产物于试管中,加盐酸溶解,再用胶头滴管向其中滴入KSCN溶液,若变红,则含有三价铁离子;
故答案为:取少量分解产物于试管中,加入足量稀盐酸溶解,再滴加几滴KSCN溶液,溶液变红色,说明有三价铁。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】(题文)高分子PMMA是迄今为止合成透明材料中质地最优异、价格又比较适宜的品种。其中一种合成路线如图。

(1)A的分子式是_________。
(2)反应II的化学方程式是_________。
(3)H是E的同分异构体,它同时符合下列条件:①能发生银镜反应;②能与H2发生加成反应;③不能发生水解反应;④分子内不含甲基。则H可能的结构简式为_________(写出任意一种)。
(4)MMA通过加聚反应制取PMMA的化学方程式是_________。
(5)已知:
 (R1、R2代表烃基或H)。
(R1、R2代表烃基或H)。
以2-丙醇(![]() )为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_________。
)为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在探究废干电池内的黑色固体回收利用时,进行了如图所示实验:

查阅教材可知,普通锌锰干电池中的黑色物质的主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作②的名称是_____。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、_____、_____和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为_____。
(3)操作④的试管中加入操作③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色滤渣中含有_____。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
实验目的 | 实验操作 | 实验现象 | 实验结论 |
①检验Cl- | 加入硝酸酸化的硝酸银溶液 | 有白色沉淀产生 | 含有Cl- |
②检验NH4+ | 取少许滤液于试管中, ____ | _____ | 含有NH4+ |
③检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入稀氨水,沉淀又溶解 | 含有Zn2+ |
(5)根据以上实验报告,关于滤液的成分,该同学的结论是滤液中含有NH4Cl和ZnCl2。若想从滤液中得到溶质固体,还应进行的操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+ C6![]() CoO2+ LiC6,下列说法正确的是
CoO2+ LiC6,下列说法正确的是
A. 充电时,电池的负极反应为 LiC6- e-="=" Li + C6
B. 放电时,电池的正极反应为 CoO2+ Li++ e-="=" LiCoO2
C. 羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D. 锂离子电池的比能量(单位质量释放的能量)低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某传感器工作原理如图所示。利用该传感器可以测定空气中NO、CO、NH3、SO2等有害气体的含量。下列说法正确的是

A. 传感器工作中,电子由Pt(Ⅰ)极经电流仪传到Pt(Ⅱ)极
B. 若M为熔融KOH,X为NH3,Y为N2,则负极的电极反应式为2NH3-6e- = N2+6H+
C. 若M是含O2-的固体电解质,X为NO,则正极的电极反应式为O2 + 4e- = 2O2-
D. 若X为CO,M为KOH溶液,则电池总反应为2CO+O2 = 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某蛋白质的结构示意图,其中“—S—S—”为由两个“—SH”脱氢形成的二硫键,其作用是连接两个相邻肽链。若该蛋白质分子共由m个氨基酸组成,则形成一个该蛋白质分子时生成的水分子数和减少的相对分子质量分别为

A. m,18m
B. (m-4),18(m-4)
C. (m-3),18(m-3)+4
D. (m-2),18(m-2)+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定的溶液中一定能大量共存的是
A. 能溶解![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B. 水电离出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 滴入KSCN显红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D. ![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在天平的左右两个托盘上放有两个烧杯,两个烧杯中分别盛有盐酸和氢氧化钠溶液,天平处于平衡状态,当分别向两烧杯中加入等质量的铝(酸和碱都是足量的)充分反应后
A. 天平保持平衡 B. 左高右低 C. 左低右高 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com