
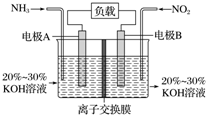
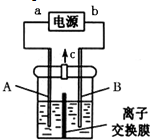
 利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )
利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 当有4.48 L NH3 (标准状况)反应时,转移电子为0.6 mol |
分析 根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则A是正极、B是负极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O,正极反应式为2NO2+8e-+4H2O=80H-+N2,据此分析解答.
解答 解:根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由-3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则A是正极、B是负极,负极电极方程式为2NH3-6e-+60H-=N2+6H2O,正极反应式为2NO2+8e-+4H2O=80H-+N2,
A.电子从负极沿导线流向正极,则电子从左侧电极经过负载后流向右侧电极,故A错误;
B.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,故B正确;
C.电极A极反应式为2NH3-6e-+6OH-═N2+6H2O,故C正确;
D.电极A极反应式为2NH3-6e-+6OH-═N2+6H2O,当有4.48 L NH3 (标准状况)反应时,参加反应的氨气物质的量为0.2mol,转移电子物质的量=0.2mol×[0-(-3)]=0.6 mol,故D正确;
故选A.
点评 本题考查化学电源新型电池,为高频考点,明确化学反应中化合价升降与正负极的关系是解本题关键,难点是电极反应式的书写,注意电子流向判断,题目难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 | |
| B. | 25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 | |
| C. | 25℃时,0.2 mol/L NaOH溶液与0.2 mol/L H2SO4恰好中和,所得溶液的pH<7 | |
| D. | 25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠浮在水面上 | B. | 金属钠形成小球状 | ||
| C. | 金属钠在水面上迅速游动 | D. | 反应后的溶液呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子的比例模型: | B. | 如图所示一定代表丙烯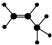 | ||
| C. | 12C32S2比12C34S2更易挥发 | D. | O${\;}_{2}^{2-}$电子式为: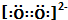 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
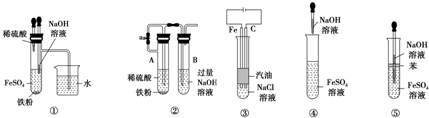
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②③④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧热的热化学方程式为:CO (g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0 kJ•mol-1 | |
| B. | 稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ•mol-1,则表示稀硫酸与稀氢氧化钾溶液中和热的热化学方程式为:$\frac{1}{2}$H2SO4(l)+KOH(l)═$\frac{1}{2}$K2SO4(l)+H2O(l);△H=-57.3 kJ•mol-1 | |
| C. | 已知H-H键键能为436 kJ•mol-1,H-N键键能为391 kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1,则N≡N键的键能约为946kJ•mol-1 | |
| D. | 一定条件下,反应2CO(g)═CO2(g)+C(s)可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.
加“碘”食盐实际添加的是碘酸钾.以石墨和铁为电极,以KI溶液为电解液在一定条件下电解可制得KIO3,其简易装置如图所示.已知:3I2+6OH-═IO3-+5I-+3H2O.通电前若加入少量淀粉溶液,通电后发现右侧溶液变蓝色,一段时间后蓝色逐渐变浅.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 | B. | 1.6 | C. | 3.2 | D. | 3.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com