
已知某可逆反应:mA(g)+nB(g)⇌xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是()
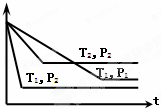
A. T1>T2,P1>P2,m+n>x,正反应放热
B. T1<T2,P1<P2,m+n<x,正反应吸热
C. T1>T2,P1<P2,m+n<x,正反应放热
D. T1<T2,P1>P2,m+n>x,正反应吸热
考点: 化学平衡建立的过程.
专题: 化学平衡专题.
分析: 温度相同时,根据到达平衡的时间判断压强大小,再根据压强对C的含量的影响,判断压强对平衡的影响,确定反应气体气体体积变化情况;
压强相同时,根据到达平衡的时间判断温度大小,再根据温度对C的含量的影响,判断温度对平衡的影响,确定反应的热效应.
解答: 解:由相同温度T1,不同压强下两条曲线比较知,速率快的压强大,P1<P2,由P1到P2,压强增大时,C百分含量下降,平衡逆向移动,所以,m+n<x;由相同压强T1,不同温度下两条曲线比较知,速率快的温度高,T1>T2,由T1到T2,温度降低时,C百分含量升高,平衡正向移动,所以,正反应放热.
故选C.
点评: 本题考查化学平衡图象问题,难度不大,本题注意根据图象判断温度、压强的大小,根据温度、压强对平衡移动的影响分析.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:
将2mol SO2和2mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2⇌2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量一定大于n mol的是()
A. 2mol SO2+1mol O2
B. 4mol SO2+1mol O2
C. 2mol SO2+1mol O2+2mol SO3
D. 3mol SO2+1mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素形成的离子aA+、bB2+、cC﹣、dD2﹣均具有相同的电子层结构,下列判断正确的是( )
|
| A. | 元素的金属性:B>A;元素的非金属性:D>C |
|
| B. | 原子序数:b>a>c>d |
|
| C. | 离子半径:D2﹣>C﹣>B2+>A+ |
|
| D. | 原子半径:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,反应X2(g)+Y2(g)⇌2XY(g)△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是()

A. 图Ⅰ是增大压强的变化情况
B. 图Ⅱ是一定是加入催化剂的变化情况
C. 图Ⅲ是增大压强或升高温度的变化情况
D. 图Ⅲ一定是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
下列能用勒沙特列原理解释的是()
①红棕色NO2加压后颜色先变深后变浅
②SO2催化氧化成SO3的反应,往往加入过量的空气
③Fe(SCN)3溶液中加入固体KSCN后颜色变深
④氯水宜保存在低温、避光条件下
⑤乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利.
A. ①②⑤ B. ②③④ C. ①②③⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实均能说明醋酸是弱电解质的是()
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol/L醋酸溶液的pH比0.1mol/L盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,开始醋酸产生H2速率慢.
A. ②③⑥ B. ④⑤⑥ C. ③④⑥ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的.”利用盖斯定律可测某些特别反应的热效应.
(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=﹣2983.2kJ/mol
(2)P(s,红磷)+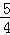 O2(g)=
O2(g)=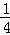 P4O10(s)△H2=﹣738.5kJ/mol
P4O10(s)△H2=﹣738.5kJ/mol
则白磷转化为红磷的热化学方程式 .相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com