
【题目】甲醇是一种很好的燃料,工业上在一定条件下可利用反应I和II来制备:
(1)已知在25°C、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则表示燃烧热的热化学方程式为___
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L密闭容器中,CH4(g)+H2O(g)CO(g)+3H2(g)(I)CH4的转化率与温度、压强的关系如图所示:

①该反应的△H__0,△S__0(填“<”、“>”或“=”);
②已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为___,该反应的平衡常数为___(mol·L-1)2。
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)CH3OH(g)△H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___(填序号)。
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大 D.再充入amolCO和3amolH2
【答案】CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ·mol-1 > > 0.030molL-1min-1 2.25×10-2 BD
【解析】
(1)燃烧热指1mol纯物质完全燃烧生成稳定氧化物时所释放出的热量,由1g甲醇燃烧生成CO2和液态水时放热22.68kJ,计算1mol甲醇完全燃烧生成CO2和液态水时放出的热量热量,进一步写出热化学方程式;
(2)①由反应CH4(g)+H2O(g)CO(g)+3H2(g)可知反应为熵增加的反应,温度升高,CH4的转化率增大,平衡正向移动,正反应吸热;
②由图可知100℃时,CH4的转化率为0.5,根据三段法进行计算
(3)增加甲醇产率需要是平衡正移,根据平衡移动原理进行分析。
(1)燃烧热指1mol纯物质完全燃烧生成稳定氧化物时所释放出的热量,由1g甲醇燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇32g,放出的热量为725.76kJ,热化学方程式为CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ·mol-1 ;
(2)①由反应CH4(g)+H2O(g)CO(g)+3H2(g)可知反应为熵增加的反应,温度升高,CH4的转化率增大,平衡正向移动,正反应吸热,即△H>0,△S>0;
②由图可知100℃时,CH4的转化率为0.5,设CH4转化了x mol/L,则
CH4(g)+H2O(g)CO(g)+3H2(g)
始(mol/L) 0.1 0.2 0 0
转(mol/L) x x x 3x
平(mol/L) 0.1-x 0.2-x x 3x ![]() =0.5 x=0.05mol/L
=0.5 x=0.05mol/L
v=![]() =
=![]() =0.03molL-1min-1
=0.03molL-1min-1
K=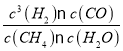 =
=![]() =2.25×10-2
=2.25×10-2
(3)增加甲醇产率需要是平衡正移,反应为CO(g)+2H2(g)CH3OH(g)△H<0,
A.升高温度,平衡向吸热的方向移动,即平衡逆向移动,A项错误;
B. 将CH3OH(g)从体系中分离出来,即减小生成物浓度,平衡正向移动,B项正确;
C. 恒容下充入He,使体系的总压强增大,但各物质的浓度不变,平衡不移动,C项错误;
D. 再充入amolCO和3amolH2,增大了反应物的浓度,平衡正向移动,D项正确;
答案选BD。


科目:高中化学 来源: 题型:
【题目】25 ℃时,下列四种溶液中,由水电离生成的氢离子浓度之比是( )
①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液 ④1 mol·L-1的NaOH溶液
A. 1∶10∶100∶1 B. 1∶10-1∶10-12∶10-14
C. 14∶13∶12∶14 D. 14∶13∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验(a、b电极均为Ag单质),观察到了灵敏电流计指针发生偏转。下列说法正确的是
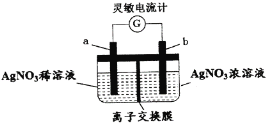
A.b极发生氧化反应
B.离子交换膜为阴离子交换膜
C.去掉离子交换膜,电流表仍然有电流通过
D.电流计指针不再偏转时,右边硝酸银溶液的物质的量浓度依然大于左边
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氧体是一种磁性材料,具有广泛的应用。
(1)铁元素位于元素周期表的_________区,其基态原子有___________种能量不同的电子。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是________,醋酸钠中碳原子的杂化类型是_______。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,![]() 的结构式为___________(标出配位键),与
的结构式为___________(标出配位键),与![]() 互为等电子体的分子有____________(任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________。
互为等电子体的分子有____________(任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________。
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。
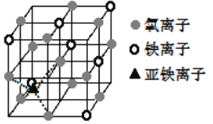
①晶胞中亚铁离子处于氧离子围成的_______________(填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为______。
③解释Fe3O4晶体能导电的原因_________;若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_____________g·cm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组的同学取一定量的Al和Fe2O3的混合物进行铝热反应,并探究熔落物的成分。已知:Al、Fe的熔、沸点数据如下。
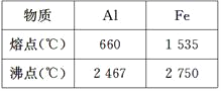
请回答下列问题:
(1)某同学猜测,铝热反应所得到的熔落物是铁铝合金。理由:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理?__(选填“合理”或“不合理”)。设计一个简单的实验方案,证明上述所得的熔落物中含有金属铝:__。
(2)另外一名同学观察到熔落物呈黑色,他认为铝热反应中有少量Fe3O4生成,该同学设计如下实验验证他的结论:取少量熔落物,用稀硫酸溶解,加水稀释后滴加3~4滴KSCN溶液。若溶液变为红色,则有Fe3O4生成;否则没有Fe3O4生成。该同学的实验方案是否合理?____说明你的理由____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com