
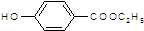
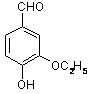 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
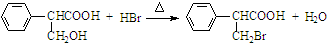 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).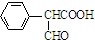 .
.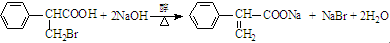 .
. )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用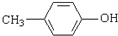 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).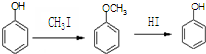
 .
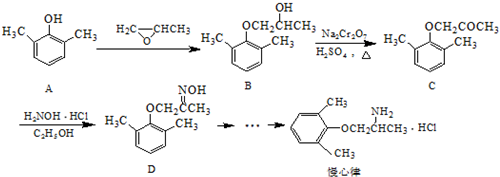
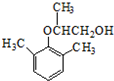
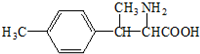
.分析 (1)乙基香草醛的同分异构体A是一种有机酸,则A中含有羧基,A被氧化后生成的B能发生银镜反应,则说明B含有醛基,A含有-CH2OH,由A与C的分子式可知,A中-OH被-Br取代生成C,A能被酸性高锰酸钾溶液氧化生成苯甲酸,一定条件下可以生成高分子化合物D,所以A是 ,则B为
,则B为 ,C为
,C为 ;
;
(2)先将对甲基苯酚和甲碘烷反应生成对甲基甲苯醚,然后将对甲基甲苯醚与酸性高锰酸钾溶液反应,将甲基氧化为羧基,羧基和乙醇发生酯化反应生成酯基,再和HI反应生成酚羟基,从而实现转化;
(3)根据条件①能与NaHCO3溶液反应,说明有羧基,②遇FeCl3溶液显紫色,且能与浓溴水反应,说明有酚羟基,且酚羟基的邻对位苯环上至少有一个氢原子,③苯环上有两个烃基,④苯环上的官能团处于对位,注意烃基不是官能团,据此写乙基香草醛的同分异构体.
解答 解:(1)乙基香草醛的同分异构体A是一种有机酸,则A中含有羧基,A被氧化后生成的B能发生银镜反应,则说明B含有醛基,A含有-CH2OH,由A与C的分子式可知,A中-OH被-Br取代生成C,A能被酸性高锰酸钾溶液氧化生成苯甲酸,一定条件下可以生成高分子化合物D,所以A是 ,则B为
,则B为 ,C为
,C为 ;
;
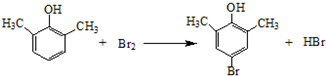
①由A→C的反应方程式为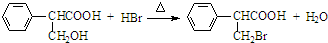 ,属于取代反应,
,属于取代反应,
故答案为: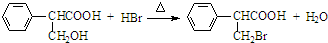 ;取代反应;
;取代反应;
②B的结构简式为 ,故答案为:
,故答案为: ;
;
③C为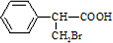 ,与碱发生水解和中和反应,发生的反应为
,与碱发生水解和中和反应,发生的反应为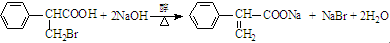 ,
,
故答案为: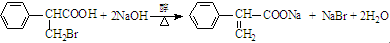 ;
;
(2)先将对甲基苯酚和甲碘烷反应生成对甲基甲苯醚,然后将对甲基甲苯醚与酸性高锰酸钾溶液反应,将甲基氧化为羧基,羧基和乙醇发生酯化反应生成酯基,再和HI反应生成酚羟基,其流程图为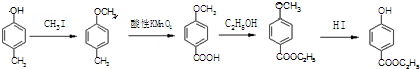 ,
,
故答案为: ;
;
(3)乙基香草醛除苯环外,还有3个C原子,3个O原子,4个H原子,条件①说明有羧基,条件②说明有酚羟基且酚羟基的临位和对位必须有空位,条件④说明羧基和酚羟基在对位,则剩余两个甲基不能都在酚羟基的临位,可见其同分异构体有: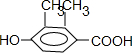

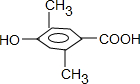 三种,其中核磁共振氢谱中出现4组峰,吸收峰的面积之比为1:1:2:6的,只有
三种,其中核磁共振氢谱中出现4组峰,吸收峰的面积之比为1:1:2:6的,只有 符合,
符合,
故答案为:3; .
.
点评 本题考查有机物推断及有机合成,为高频考点,侧重考查学生分析推断及知识综合应用能力,根据分子式及反应条件、物质性质进行推断,难点是有机合成路线设计,要求学生对常见反应类型、物质结构等熟练掌握,注意(2)中羟基的保护,易错点是(3)题同分异构体种类判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、NO3-、OH-、Cl- | B. | H+、Ba2+、Ag+、Cl- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Ca2+、H+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.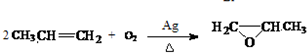 .
. .
. .
.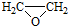 ).写出以邻甲基苯酚 (
).写出以邻甲基苯酚 (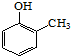 )和乙醇为原料制备
)和乙醇为原料制备 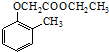 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
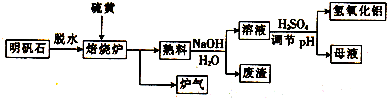
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
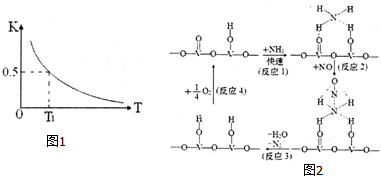 环境污染影响人类生存,治理污染是化学工作者研究的重要课题.
环境污染影响人类生存,治理污染是化学工作者研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-戊烯和2-甲基-1-丙烯 | B. | 甲醛和甲酸甲酯 | ||
| C. | 1-丁醇和甲乙醚 | D. | 丁酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的酸性废水,可利用微生物电池法除去,其原理如图2所示
)的酸性废水,可利用微生物电池法除去,其原理如图2所示 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-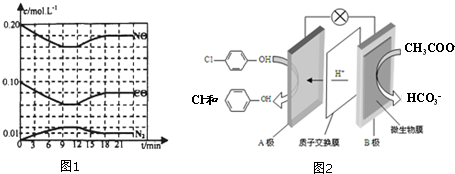
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝与Fe2O3发生铝热反应后固体物质质量不变 | |
| B. | Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 | |
| C. | 过量的铜与浓硝酸反应可生成NO | |
| D. | 由于铝元素和铁元素都有+3价,由2Al+6HCl2═AlCl3+3H2↑可知:2Fe+6HCl2═FeCl3+3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com