
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl﹣、Br﹣(溴离子)、SO42﹣、Na+、Mg2+、Ca2+等,都是重要资源.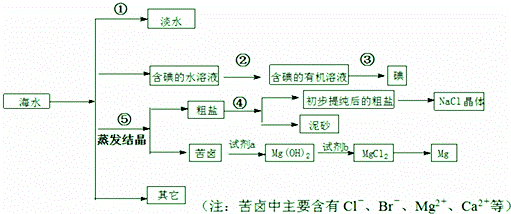
(1)写出步骤①、②、④分离提纯的方法:
① ② ④
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 .
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 量.向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体.
(4)检验淡水中是否含有Cl﹣ 的操作现象及结论 .
(5)写出加入试剂a后,发生反应的离子方程式 .
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和消石灰制取漂白粉的化学方程式 .
考点:
物质分离和提纯的方法和基本操作综合应用;海水资源及其综合利用.
专题:
化学实验基本操作.
分析:
海水中还含有大量的电解质,它们电离产生Cl﹣、Br﹣(溴离子)、SO42﹣、Na+、Mg2+、Ca2+等,
海水经过蒸馏,可得到淡水;
碘易溶于有机溶剂,可加入苯或四氯化碳进行萃取,然后蒸馏可得到碘;
海水经蒸发结晶得到粗盐,粗盐经提纯化学处理后过滤可得到氯化钠;
海水中含有氯化镁,加入石灰水,可生成氢氧化镁沉淀,过滤后在沉淀中加入盐酸可生成氯化镁,经蒸发、结晶和脱水后可得氯化镁,电解熔融的氯化镁可得金属镁,以此解答该题.
解答:
解:(1)步骤①为海水的淡化,可用蒸馏操作分离,②为碘的萃取和分液,④为过滤,粗盐经提纯化学处理后过滤可得到氯化钠溶液,
故答案为:①蒸馏; ②萃取分液; ④过滤;
(2)步骤②分离提纯方法为萃取,需要选用主要玻璃仪器为分液漏斗、烧杯,故答案为:分液漏斗、烧杯;
(3)镁离子会与氢氧根离子、碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,过滤后加入盐酸可以除去过量的碳酸钠和氢氧化钠,需要依次加入稍过量的NaOH、BaCl2 、Na2CO3、过滤、在滤液中加入盐酸至不再有气体生成,将所得溶液加热浓缩、冷却结晶,得到精盐,
故答案为:BaCl2;Na2CO3;稍过量;稀盐酸;
(4)实验室检验Cl﹣,可利用Cl﹣与硝酸银反应生成不溶于硝酸的AgCl的性质进行检验,操作方法为取样,先滴加几滴稀硝酸,再滴加硝酸银,若产生白色沉淀则有Cl﹣,
故答案为:取样,先滴加几滴稀硝酸,再滴加硝酸银,若产生白色沉淀则有Cl﹣;
(5)加入试剂a后,发生反应的离子方程式为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(6)氯气和消石灰反应生成氯化钙和次氯酸钙,反应的化学方程式为2Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评:
本题考查了混合物除杂的实验方案分析,氧化还原反应的强弱规律应用,离子方程式的书写方法等知识,为高频考点,侧重于学生的分析能力和实验能力的考查,体现化学来源于生产、生活,又服务于生产、生活的理念,题目难度中等.


科目:高中化学 来源: 题型:
按官能团的不同,可以对有机物进行分类,请指出下列有机物官能团的名称,填在横线上.
(1)CH3COCH2COOH ;
(2)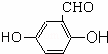 ;
;
(3)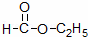 ;
;
(4)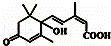 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
|
| A. | ﹣488.3 kJ/mol | B. | +488.3 kJ/mol |
|
| C. | ﹣191 kJ/mol | D. | +191 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示.下列判断正确的是( )

|
| A. | 原子半径:丙<丁<戊 | B. | 氢氧化物碱性:丙>丁>戊 |
|
| C. | 金属性:甲>丙 | D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
“铝热反应”的化学方程式为:2Al+Fe2O3 Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ﹣﹣ |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是: .
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,当观察到 现象时,说明熔融物中含有金属铝,反应的离子方程式为 .
(3)实验室溶解该熔融物,最好选用下列试剂中的 (填序号).
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
2006年5月14日某新闻媒体报道齐齐哈尔第二制药有限公司生产的假药事件,“齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡.二甘醇又称乙二醇醚,分子式为C4H10O3(HO﹣CH2﹣CH2﹣O﹣CH2﹣CH2﹣OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4﹣二恶烷等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛.二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为 .
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是 ,该反应属于 取代反应 (添反应类型).写出B可能生成E的化学方程式: .
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A: B: C:
(5)反应Ⅲ的化学方程式为: .
(6)写出二甘醇制备1,4﹣二恶烷的化学方程式: H.
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭发射的燃料有很多,偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力.下列叙述中正确的是( )
A. 6.02×1023个偏二甲肼分子的质量为60g
B. 偏二甲肼的摩尔质量为60g
C. 1mol偏二甲肼的质量为60g/mol
D. 6g偏二甲肼含有NA个偏二甲肼分子
查看答案和解析>>
科目:高中化学 来源: 题型:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)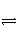
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1) 写出该反应的平衡常数表达式:K=_____________________________________。
已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=_____________________________________
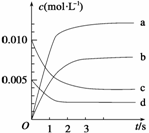
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体b.适当升高温度c.增大O2的浓度d.选择高效催化剂
附加题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com