
(14分)、请回答下列问题。
(1)钢铁的电化学腐蚀原理如图所示:写出石墨电极的电极反应式_____________________;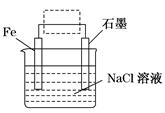
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下: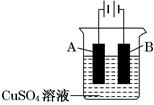
①A电极的电极反应式是________________________。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为4.48 g,则电镀时电路中通过的电子为________ mol。(3)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。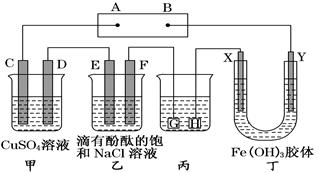
请回答:
①若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为________。
②当乙中溶液的pH是13时(此时乙溶液体积为500 mL),甲中溶液的pH为________。
③丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这种现象称为 ________
④乙中发生的反应方程式为:________________________。
(1)O2+4e-+2H2O===4OH-(2)Cu — 2e-=== Cu2+ 0.07(3)1∶2∶2∶2 1 电泳 2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
解析试题分析:
(1)此为钢铁的吸氧腐蚀,石墨做正极,电极反应式:O2+4e-+2H2O===4OH-。
(2)①A连接的为电源的正极做阳极,按电镀原理,阳极为镀层金属失去电子,故电极反应式: Cu—2e-=Cu2+
②、铜两片金属质量相差4.48g,即反应铜2.24g,转移电子为:2.24g ¸64g/mol´2=0.07mol。
(3)①将直流电源接通后,F极附近呈红色,说明F为阴极:2H+ + 2e- =H2,则E为阳极产生单质Cl2,D为阴极产生单质Cu,C为阳极产生单质O2。根据电子守恒C、D、E、F对应单质的物质的量之比为1∶2∶2∶2。
②根据电子守恒,乙中每产生1mol氢氧化钠,甲中产生0.5mol硫酸,所以甲乙对应产生的氢离子与氢氧根离子浓度相等,当乙中溶液的pH是13时,甲中溶液的pH为1。
③在外加电场的作用下,带电的胶体粒子发生定向移动的现象叫电泳。
④乙电解食盐水:NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
考点:电解原理,电镀原理,氯碱工业。
点评:此题综合电解原理,电镀原理,氯碱工业原理,学生需对这些知识有较深理解。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
 液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:
液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 750-970oC | 通电,Na3AIF6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ((Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
((Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com