
| A、氯化钠 食盐 NaCl2 |
| B、碳酸氢钠 纯碱 NaHCO3 |
| C、氢氧化钙 熟石灰 CaO |
| D、氢氧化钠 烧碱 NaOH |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、标准状况下,15g乙烷中含有共价键的数目为3NA |
| C、1mol Na被完全氧化生成Na2O2,失去2NA个电子 |
| D、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钾溶液在电流作用下电离成K+和Cl- |
| B、氧化还原反应的本质是有化合价的升降 |
| C、依据丁达尔效应可将分散系分为溶液、胶体与浊液 |
| D、硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸热反应一定不能自发进行 |
| B、△H大于零的反应是放热反应 |
| C、已知S(单斜,s)=S(正交,s)△H<0,则单斜硫比正交硫稳定 |
| D、应用盖斯定律,可计算某些难以直接测量的反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
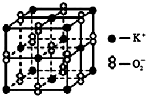 高温下,超氧化钾晶体(KO2)呈立方体结构(与NaCl晶体结构相似).如图为超氧化钾晶体的一个晶胞.则有关下列说法不正确的是( )
高温下,超氧化钾晶体(KO2)呈立方体结构(与NaCl晶体结构相似).如图为超氧化钾晶体的一个晶胞.则有关下列说法不正确的是( )| A、KO2中既存在离子键也存在共价键 |
| B、一个KO2晶胞中摊得的K+和O2-粒子数均为4个 |
| C、晶体中与每个K+距离最近的O2-有8个 |
| D、与K+距离相等且最近的K+有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
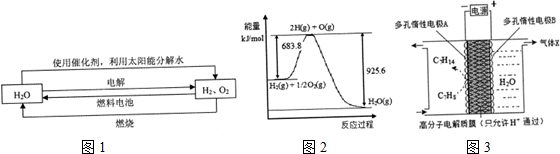
| ||
| ||
| 催化剂 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
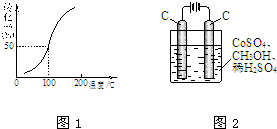 甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题.
甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题.| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com