
【题目】Na2S2O35H2O在化学定量分析中常用作基准物质,实验室制备原理为Na2S + Na2CO3 + 4SO2 ![]() 3Na2S2O3 + CO2。现设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3 + CO2。现设计如下装置(夹持仪器省略)进行实验。

(1)A中发生反应的化学方程式为_______________________________。
(2)C中所盛试剂可能是_______________;若要停止A中的化学反应,除取下酒精灯加热外,还可以采取的操作是__________________________。
(3)甲同学在加热A后,发现液面下的铜丝变黑。该同学对黑色生成物提出如下假设:
① 可能是CuO; ② 可能是Cu2O; ③ 可能是CuS
乙同学认为假设②一定不成立,依据是__________;该同学设计如下实验进一步验证黑色物质的组成:
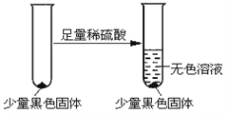
基于上述假设分析,黑色物质的组成为________(填化学式)。
(4)实验室用Na2S2O3标准溶液测定废水中Ba2+ 的浓度,过程如下:(已知:2S2O32-+I2==S4O62-+2I-)。
![]()
① 写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式:________;
② 若以淀粉为指示剂,则达到滴定终点时的现象是__________________。
③ 若Na2S2O3标准溶液的浓度为0.0030 molL-1,消耗该Na2S2O3标准溶液的体积如图所示,则废水中Ba2+ 的浓度为___________。
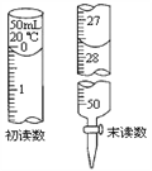
【答案】Cu+2H2SO4![]() CuSO4+SO2↑+2H2ONaOH溶液将铜丝抽离液面Cu2O是砖红色沉淀CuS2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O淀粉溶液由蓝色变为无色,且半分钟内不变色0.0011mol/L或1.1×10-3 mol/L
CuSO4+SO2↑+2H2ONaOH溶液将铜丝抽离液面Cu2O是砖红色沉淀CuS2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O淀粉溶液由蓝色变为无色,且半分钟内不变色0.0011mol/L或1.1×10-3 mol/L
【解析】
由题中信息可知,A为制备二氧化硫气体的装置,B为制备硫代硫酸钠的装置,C为尾气处理装置。
(1)A中发生反应的化学方程式为Cu+2H2SO4![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)C的作用是吸收尾气中的二氧化硫气体,防止污染空气。二氧化硫是一种酸性氧化物,故其中所盛试剂可能是NaOH溶液;若要停止A中的化学反应,除取下酒精灯加热外,还可以采取的操作是将铜丝抽离液面。
(3)甲同学在加热A后,发现液面下的铜丝变黑。该同学对黑色生成物提出如下假设:
① 可能是CuO; ② 可能是Cu2O; ③ 可能是CuS
乙同学认为假设②一定不成立,依据是Cu2O是砖红色沉淀;
由图中信息可知,黑色物质不溶于稀硫酸中,基于上述假设分析,黑色物质的组成为CuS。
(4)实验室用Na2S2O3标准溶液测定废水中Ba2+ 的浓度,过程如下:(已知:2S2O32-+I2==S4O62-+2I-)。
![]()
由上述实验流程可知,废水中加入足量的重铬酸钾溶液把其中的钡离子沉淀为铬酸钡,过滤,再用HI和稀盐酸把沉淀溶解,最后加入硫代硫酸钠溶液滴定。
① BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式为:2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O;
② 滴定终点时,碘转化为碘离子,若以淀粉为指示剂,则达到滴定终点时的现象是:淀粉溶液由蓝色变为无色,且半分钟内不变色。
③ 由图可知,消耗该Na2S2O3标准溶液的体积为27.50mL,若Na2S2O3标准溶液的浓度为0.0030 molL-1,由化学方程式及电子转移守恒可知,n(Ba2+)=![]() ,则废水中Ba2+ 的浓度为
,则废水中Ba2+ 的浓度为![]() 1.1×10-3 mol/L。
1.1×10-3 mol/L。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )

A. 原子半径:W>Z>Y>X
B. X的氢化物于水形成的溶液呈碱性
C. 最简单气态氢化物的热稳定性:Z>W
D. Y元素的最高价氧化物的水化物不与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子核外M电子层上有3个电子,元素Y的离子Y2核外有18个电子,则这两种元素可形成的化合物为( )
A.XY2B.X2Y3C.X3Y2D.X2Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:

(1)第①步反应中的硫酸能否用浓盐酸代替?____(填“能”或“否”),理由是______________。
(2)第②步操作中,氧化性强弱顺序:ClO3—___MnO2(填“>”或“<”),写出操作②中发反应的离子方程式:____;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。制取K2MnO4的化学反应方程式为______,工业上不断搅拌的目的是______。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为______%(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下述装置制取氯气,并用氯气进行下列实验。看图回答下列问题:

(1)A、B两仪器的名称:A________,B________。
(2)洗气装置C是为了除去Cl2中的HCl气体,D是为了干燥Cl2,则C、D中应分别放入C_______;D________
①NaOH溶液 ②饱和食盐水 ③AgNO3溶液 ④浓H2SO4
(3)E中为红色干布条,F中为红色湿布条,可观察到______________________________。
(4)G是浸有淀粉KI溶液的棉花球,G处现象是棉花球表面变成____________。反应的离子方程式是_______,H是浸有NaBr溶液的棉花球,H处现象是棉花球表面变________。
(5)P处为尾气吸收装置,可选用____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
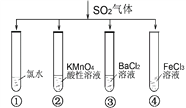
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:

下列说法正确的是
A. 离子半径的大小顺序:e>f>g>h
B. 与x形成简单化合物的沸点:y>z>d
C. x、z、d三种元素形成的化合物可能含有离子键
D. e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com