
| A. | FeCl2 | B. | AgNO3 | C. | KI | D. | Na2CO3 |
科目:高中化学 来源: 题型:选择题
| A. | 强酸和强碱溶液的反应可以设计成原电池 | |
| B. | 白铁(镀锌铁)破损时与电解质溶液接触,锌被腐蚀 | |
| C. | 电解池内发生的反应均为自发进行的氧化还原反应 | |
| D. | 用惰性电极电解足量饱和食盐水后,可加盐酸使溶液恢复至原状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
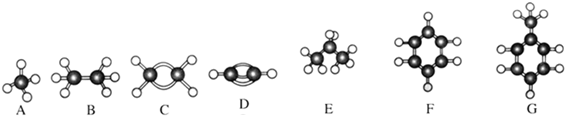
| 试剂 | |
| 乙烷混有少量乙烯 | |
| 溴苯混有少量溴单质 |
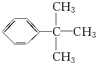 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与醋酸溶液反应:CaCO3+2H +═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水和盐酸反应:OH-+H+═H2O | |
| C. | 用Na2O2溶于水:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 偏铝酸钠溶液通入过量CO2:AlO2-+4CO2+2 H2O═Al3++4 HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com