
【题目】A、D、F均是常见元素组成的单质,B是淡黄色固体,常温下C是液体。
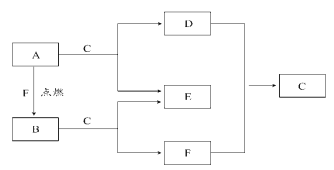
请回答下列问题:
(1)B和E的化学式:B__,E___。
(2)A与C反应的离子方程式为___;A与F生成B的化学方程式为___。
(3)关于A的叙述中正确的是___(填序号)。
①A有很强的还原性 ②A的焰色反应呈紫色
③少量A可以保存在冷水里 ④A着火时应用细沙盖灭
(4)将A、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体体积之比是__。
①1∶2∶3 ②6∶3∶2 ③3∶1∶1 ④1∶1∶1
【答案】Na2O2 NaOH 2Na+2H2O=2Na++2OH-+H2↑ 2Na+O2![]() Na2O2 ①④ ③
Na2O2 ①④ ③
【解析】
A、F均是常见元素组成的单质,点燃时,生成B是淡黄色固体,则B为过氧化钠;A与常温下是液体的C反应,可确定A为Na,C为水,则F为氧气;D为氢气,E为NaOH。
(1)分析可知,B为过氧化钠,E为氢氧化钠,化学式分别为Na2O2、NaOH;
(2)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;钠与氧气反应生成过氧化钠,方程式为2Na+O2![]() Na2O2;
Na2O2;
(3)①A为Na,很容易失去最外层一个电子,有很强的还原性,①叙述正确;
②A的焰色反应呈黄色,②叙述错误;
③钠与水反应,A不能保存在冷水里,③叙述错误;
④Na与细沙不反应,且能隔绝空气,则着火时应用细沙盖灭,④叙述正确;
答案为①④;
(4)Na除能与盐酸反应生成氢气外,还能与水反应生成氢气,则Na生成氢气的量为0.15mol;100mL1mol/L盐酸中含有氢离子为0.1mol,则镁、铝只能生成0.05mol氢气,则生成氢气的物质的量之比为0.15:0.05:0.05=3:1:1,答案为③。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是___。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下移动
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=__(取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在光学器件石油探测、安检、环境监测等领域有重要应用。某研究小组开发设计的制备高纯NaI的简化流程如图:
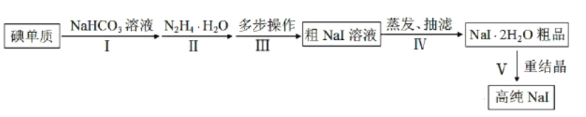
已知:
①I2(s)+I-(aq)![]() I
I![]() (aq)。
(aq)。
②水合肼(N2H4H2O)具有强还原性,可分别将碘的各种酸根和I2还原为I-,本身被氧化为无毒物质。
③NaI易溶于水,也易溶于酒精,在酒精中的溶解度随温度的升高增加不大。
请回答:
(1)步骤Ⅰ,I2与NaHCO3溶液发生歧化反应,生成物中含IO-和IO![]() 离子。
离子。
①I2与NaHCO3溶液反应适宜温度为40~70℃,则采用的加热方式为__。
②实验过程中,加少量NaI固体能使反应速率加快,其原因是__。
(2)步骤Ⅱ,水合肼与IO-反应的离子方程式为__。
(3)步骤Ⅲ,多步操作为:
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH值至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH值调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH值时依次加入的试剂为__。
A.NaOH B.HI C.NH3H2O D.高纯水
(4)步骤Ⅳ,采用改进的方案为用“减压蒸发”代替“常压蒸发”。
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有__。
A.直形冷凝管 B.球形冷凝管 C.烧杯 D.抽气泵
②采用“减压蒸发”的优点为__。
(5)将制备的NaI2H2O粗品以95%乙醇为溶剂进行重结晶。请给出合理的操作排序__。
加热95%乙醇→____→___→___→____→纯品(选填序号)。
①减压蒸发结晶 ②NaI2H2O粗品溶解 ③趁热过滤 ④真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以H2O2为氧化剂直接将CH4氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”(指能量相同的原子轨道在全满、半满、全空状态时,体系的能量最低),该原子的外围电子排布式为_____。
(2)在3d过渡金属中,基态原子未成对电子数最多的元素是_____(填元素符号)。
(3)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(4)石墨烯限域单原子铁能活化CH4分子中的C-H键,导致C与H之间的作用力_____ (“减弱”或“不变”)。铁晶体中粒子之间作用力类型是_____。
(5)常温下,H2O2氧化CH4生成CH3OH、HCHO、HCOOH等。
①它们的沸点分别为64.7℃、-19.5℃、100.8℃,其主要原因是_____;
②CH4和HCHO比较,键角较大的是_____,主要原因是_____。
(6)钴晶胞和白铜(铜镍合金)晶胞分别如图1、2所示。
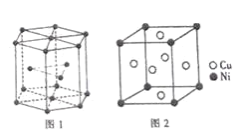
①钴晶胞堆积方式的名称为_____;
②已知白铜晶胞的密度为dg·cm-3,NA代表阿伏加德罗常数的值。图2晶胞中两个面心上铜原子最短核间距为_____ pm(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现了在细胞层面上对新型冠状病毒(2019-nCOV)有较好抑制作用的药物:雷米迪维或伦地西韦(RemdeSivir,GS-5734)、氯喹 (ChloroqquinE,Sigma-C6628)、利托那韦 (Ritonavir)。其中利托那韦(Ritonavir)的结构如下图,关于利托那韦说法正确的是
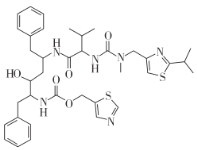
A.能与盐酸或 NaOH溶液反应
B.苯环上一氯取代物有 3种
C.结构中含有 4个甲基
D.1mol该结构可以与13molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.某无色澄清透明溶液中:K+ H+ Fe2+ Cl-
B.含0.1 mol·L-1OH-的溶液中:Na+ K+ ![]() ClO-
ClO-
C.含0.1 mol·L-1![]() 的溶液中:K+ Ca2+
的溶液中:K+ Ca2+ ![]()
![]()
D.含0.1 mol·L-1OH-的溶液中:Fe3+ ![]() Cu2+
Cu2+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的常用试剂是___,证明Fe3+存在的现象是____,配制含Fe2+的溶液时,常常向溶液中加入少量___,使被氧气氧化形成的Fe3+还原为Fe2+。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式:___。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
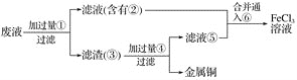
A.请写出上述实验中加入或生成的有关物质的化学式。
①___,②___,③___,④____,⑤____,⑥_____。
B.请写出相关反应的化学方程式。_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10.00mL0.1000mol·L-1HCl和0.1000mol·L-1CH3COOH的混合溶液中滴入0.1000mol·L-1NaOH溶液,溶液pH的变化曲线如图所示。已知:常温下,Ka(CH3COOH)=1.75×10-5。下列叙述错误的是
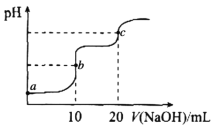
A.a点所示溶液中,CH3COOH的电离度约为1.75×10-2%
B.a、b、c三点所示溶液中,水的电离程度最大的是c点
C.c点所示溶液中:c(Na+)>c(C1-)>c(CH3COOH>c(OH-)>c(H+)
D.加热b点所示溶液,![]() 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
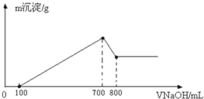
【题目】(1)我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:____________、___________.
(2)取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的标准状况下H2体积分别为33.6L、22.4L则该合金中镁、铝的物质的量之比为___________。
(3)将一定质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.则盐酸的物质的量浓度(假设反应前后溶液体积的变化忽略不计)_______________.产生沉淀质量的最大值_____________g.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com