

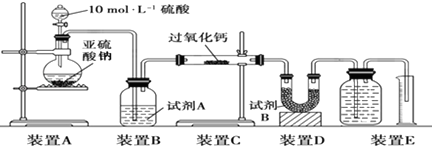
���� ��1����ͼ��֪��Ϊ��������Ʊ�������װ�ã����Ȼ�����������Ƽ��ȷ�Ӧ�����Ȼ��ơ�ˮ��������
��2��V�����νṹ�ɷ�ֹ������
��3���Ȼ��ơ�����������������Һ��Ӧ����CaO2•8H2O���Ȼ�泥�
��4����ȡCaO2•8H2Oһ���ڵ����½��У����¶ȸ߷ֽ⡢�¶ȵͽ���йأ�
��5��װ��EΪ��ˮ���ⶨ����������Ϊ��ˮ�ų������ܶ̽�������
��6�������������ʯ�ҷ�Ӧ��
��7����װ�ÿ�֪��A���������������Ʒ�Ӧ���ɶ�������B��ΪŨ���ᣬ�������壬C��������2SO2+2CaO2�T2CaSO3+O2��E�вⶨ����Ϊ�����������������SO2+CaO2�TCaSO4��D�м�ʯ������û�з�Ӧ�Ķ�������E�������壬�Դ������
��� �⣺��1��ʵ���������Ȼ�狀��������ƹ�����ȡ����������ʽΪCa��OH��2+2NH4Cl$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��Ca��OH��2+2NH4Cl$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
��2������B���ص㹹���֪B�dz���©������װ�ÿ��Է��������ʴ�Ϊ����������
��3������װ��C�е����ʵó���ȡ��ԭ������ʽΪ��CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O��
�ʴ�Ϊ��CaCl2+H2O2+2NH3+8H2O=2NH4Cl+CaO2•8H2O��
��4����ȡCaO2•8H2Oһ����0�桫5��ĵ����½��У�����0�棬Һ�屻���ᣬ��Ӧ���ѣ��¶ȹ��ߣ���������ֽ����ʼӿ죬��ӦΪ���ȷ�Ӧ�����������ڷ�Ӧ������У�
�ʴ�Ϊ������0�棬Һ�屻���ᣬ��Ӧ���ѣ��¶ȹ��ߣ���������ֽ����ʼӿ죬��ӦΪ���ȷ�Ӧ���¶ȵ���������߲��ʣ�
��5��װ��E����װ�õ����ܳ����̴���������Һ��ⶨ���������װ��E�й��ƿ�еĵ�����Ӧ���̽���������
�ʴ�Ϊ��װ��E�й��ƿ�еĵ�����Ӧ���̽���������
��6��װ��EΪ�ⶨ����������������Ҫ��ʣ��Ķ��������ȥ�������Լ�B������������δ��Ӧ��SO2��
�ʴ�Ϊ������δ��Ӧ��SO2��
��7����SO2δ��������������Ӧ����ʽΪ��2CaO2+2SO2=2CaSO3+O2�����ݻ�ѧ����ʽ�ͷ�Ӧ���ؼ���E���ռ���������
2CaO2+2SO2=2CaSO3+O2 ��������
1mol 96g
$\frac{V}{22.4}$mol m1g
1mol��m1g=96g��$\frac{V}{22.4}$mol��
��ã�V=$\frac{7{m}_{1}}{30}$��
����������ȫ�������������ķ�ӦΪ��CaO2+SO2=CaSO4����Ӧ���������������ɣ�V=0��
�������������ֱ������������ɵ����������ΧΪ0��V��$\frac{7{m}_{1}}{30}$��
�ʴ�Ϊ��0��V��$\frac{7{m}_{1}}{30}$��
���� ���⿼�����ʵ��Ʊ�ʵ�������ʵ�飬Ϊ��Ƶ���㣬�������ʵ����ʡ��Ʊ�ԭ����ʵ��װ�õ����ü�ʵ�鼼��Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬��Ŀ�Ѷ��еȣ�


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢܢ� | B�� | �ܢݢ� | C�� | �ܢ� | D�� | �ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �л��ﲻ��ͨ���˹��ķ����ϳ� | |
| B�� | ����ָȼ�պ�ֻ����CO2��H2O���л��� | |
| C�� | �л���ֻ����̼��������Ԫ�� | |
| D�� | ��̼Ԫ�صĻ����ﲻһ���������л��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ������ͼ��ʾ��ϵ���Ժϳɼף������Լ�I�����Ҵ��������ڴ������������·�Ӧ�õ���
������ͼ��ʾ��ϵ���Ժϳɼף������Լ�I�����Ҵ��������ڴ������������·�Ӧ�õ���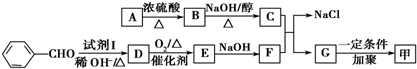
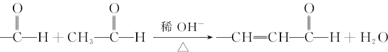
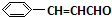 +O2$��_{��}^{����}$2
+O2$��_{��}^{����}$2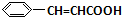 +H2O��
+H2O��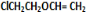 +
+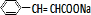 $\stackrel{һ������}{��}$
$\stackrel{һ������}{��}$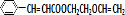 +NaCl��
+NaCl��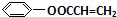 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3X2+Y2�T2X3Y | B�� | 2X2+Y2�T2X2Y | C�� | X2+2Y2�T2XY2 | D�� | X2+3Y2�T2XY3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
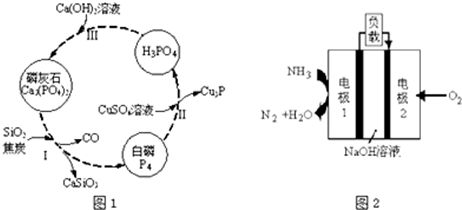
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
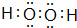 ��
��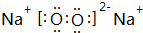 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com