
| 实验目的 | 实验操作 | 实验原理 | |
| A | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯化钠中混有少量的硝酸钾,不能制得硝酸钾的饱和溶液;
B.稀硫酸能抑制氯化铁水解,但引进新的杂质;
C.一水合氨是弱电解质,在水溶液中部分电离;
D.溶解度大的物质能转化为溶解度小的物质.
解答 解:A.氯化钠中混有少量的硝酸钾,氯化钠是大量的,制得的饱和溶液中硝酸钾量较少,不能采取降温结晶的方法,故A错误;
B.稀硫酸能抑制氯化铁水解,但引进新的杂质,应该加入稀盐酸抑制氯化铁水解,故B错误;
C.一水合氨是弱电解质,在水溶液中部分电离,所以氨气溶于水后在水溶液中主要以一水合氨存在,故C错误;
D.溶解度大的物质能转化为溶解度小的物质,将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,发生反应3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+,白色沉淀转化为红褐色,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离提纯、盐类水解、弱电解质的电离、难溶物转化等知识点,明确实验原理及物质性质是解本题关键,注意根据物质性质差异性选取合适的分离提纯方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | SO3 | B. | NO2 | C. | Al2O3 | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
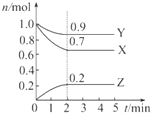 某温度时,在2L 容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在2L 容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑦ | B. | ②⑤⑦ | C. | ①③④ | D. | ②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验得到的NaCl中无其他任何杂质 | |
| B. | 检验所得NaCl中是否混有BaCl2,可用AgNO3溶液检验 | |
| C. | 该实验基本操作分为溶解、过滤和蒸发三个步骤 | |
| D. | 除去杂质时,不必考虑所加试剂的顺序 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com