
| ||
| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、10g H2和10g O2 |
| B、5.6L N2(标准状况)和11g CO2 |
| C、9g H2O和11.2L H2O(标准状况) |
| D、224mL H2(标准状况)和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 | 结 论 | |
| (1) | 取少量该溶液于试管中, 滴加无色酚酞溶液 | 该溶液显碱性 | |
| (2) | 另取少量该溶液于试管中,滴加稀盐酸 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅根据实验①能说明还原性:Br->Cl- |
| B、仅根据实验②能说明氧化性:Br2>I2 |
| C、上述实验验证了Cl2、Br2、I2的氧化性相对强弱 |
| D、向实验③所得溶液中加CCl4,充分振荡,下层为橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,它们之间存在如图所示的转化关系.下列判断正确的是( )| A、X是羧酸,Y是酯 |
| B、Z是醛,W是羧酸 |
| C、Y是醛,W是醇 |
| D、X是醇,Z是酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
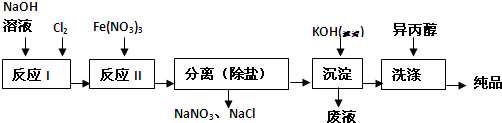
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com