
I.煤化工中常需研究不同溫度下平衡常数、投料比等问题。
已知:CO (g) +H2O(g) H2 (g) +CO2
(g)平衡常数K随温度的变化如下表:
H2 (g) +CO2
(g)平衡常数K随温度的变化如下表:

回答下列问题
(1)该反应的平衡常数表达式K=______,ΔH=______0(填“<”、“>”、“=”)
(2)已知在一定温度下,CCs) +CO2 (g) 2C0
Cg)平衡常数K1;
2C0
Cg)平衡常数K1;
C (s)
+H2O (g) CO
Cg) +H2 (g)平衡常数K2
CO
Cg) +H2 (g)平衡常数K2
则K、K1 、K2,之间的关系是______:
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为:若保持其他条件不变,向平衡体系中 再通入0.10molCO和0.40molCO2,此时v正 ______v逆 (填“>”、“=”或“<”)。
II.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。
(4) 向酸性KmnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KmnO4耗尽后,紫色溶 液将褪去。为确保能观察到紫色褪去,H2C2O4与KmnO4初始的物质的量需要满足的关 系为n(H2C2O4): n(KMnO4) ______。
(5) 为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案

表中x= ______ ml ,理由是______。
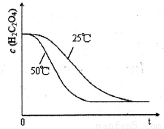
(6) 已知50°C时,浓度c(H2C2O4)随反应时间t的变化曲线如图示,若保持其他条件不变,请在答题卡坐标图 中画出25°C时c(H2C2O4)随t的变化曲线示意图。

(1)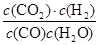 <
<
(2)K=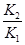
(3)80% =
(4)≥2.5
(5)2.0 保证其他条件不变,只改变反应物H2C2O4浓度,从而才打到对照试验目的。
(6)如下图
【解析】
试题分析:
(1)反应物、生成物都是气体,K=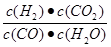 。由表格中数据可知随着温度升高,K减小,说明正反应是放热反应。
。由表格中数据可知随着温度升高,K减小,说明正反应是放热反应。
(2)C (s)
+H2O (g) CO
(g) +H2 (g)可由另两个反应相加得到,所以K1=K×K2。
CO
(g) +H2 (g)可由另两个反应相加得到,所以K1=K×K2。
(3)设转化的CO物质的量为x,由K=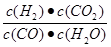 =
=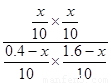 =1得x=0.32,所以CO转化率为0.8。若再充入0.1molCO、0.4molCO2,此时Q=
=1得x=0.32,所以CO转化率为0.8。若再充入0.1molCO、0.4molCO2,此时Q=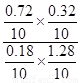 =1,平衡不移动,正、逆反应速率相等。
=1,平衡不移动,正、逆反应速率相等。
(4)草酸被高锰酸钾氧化生成二氧化碳、高锰酸钾被还原生成Mn2+,由得失电子相等得二者恰好完全反应时草酸与高锰酸钾物质的量比为5:2,为确保观察到紫色褪去,草酸与高锰酸钾物质的量比应不小于2.5。
(5)探究反应物浓度对化学反应速率的影响,保证其它条件不变,只改变草酸的浓度,由高锰酸钾浓度不变可知两组溶液体积均为13mL,所以x=2。
(6)温度越低,反应速率越慢,草酸浓度变化小。
考点: 化学平衡常数 转化率 化学平衡移动 氧化还原反应 化学反应速率 化学实验


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com