
分析 (1)依据化学平衡三段式列式计算平衡常数,平衡常数为生成物浓度幂之积比反应物浓度幂之积;
(2)依据化学平衡移动原理分析平衡常数随温度的变化,此反应为放热反应,升高温度,平衡左移;
(3)设转化的氢气为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
解答 解:(1)在某温度下,将H2和I2各0.10mol的气态混合物充入l0L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L,化学平衡三段式列式
I2 +H2=2HI
起始量(mol/L) 0.01 0.01 0
变化量(mol/L) 0.002 0.002 0.004
平衡量(mol/L) 0.008 0.008 0.004
该温度下的平衡常数K=$\frac{{c}^{2}(HI)}{c({I}_{2})×c({H}_{2})}$=$\frac{0.00{4}^{2}}{0.008×0.008}$=0.25;
故答案为:0.25;
(2)由于此反应的△H<0,即为放热反应,故升高温度,平衡左移动,平衡常数减小,故答案为:减小;
(3)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L,
则 H2(g)+I2(g)?2HI(g)
起始时各物质的浓度(mol•L-1) 0.02 0.02 0
各物质的浓度变化量(mol•L-1) x x 2x
平衡时各物质的浓度(mol•L-1) 0.02-x 0.02-x 2x
K=$\frac{(2x)^{2}}{(0.02-x)^{2}}$=0.25,
解得:x=0.004 mol/L,
所以平衡时c(HI)=0.008mol•L-1,c(H2)=0.0160mol/L,c(I2)=0.0160mol/L,故答案为:0.016 mol•L-1;0.016 mol•L-1;0.008 mol•L-1.
点评 本题考查了化学平衡的计算应用,平衡常数和转化率的概念计算式解题关键,足以平衡常数是利用平衡浓度来计算,题目难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:多选题
 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )| A. | M的分子式为C10H10O2 | |
| B. | 1mol的M最多能被4molH2还原 | |
| C. | 如图可表示M的其中一种同分异构体的比例模型 | |
| D. | 与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 | |
| B. | 反应过程中I2置换出Cl2,由此可推断非金属性I>Cl | |
| C. | KClO3和KIO3均属于离子化合物,都只含有离子键 | |
| D. | 制备KIO3的反应中氯元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的年产量通常用来衡量一个国家的石油化工发展水平 | |
| B. | 煤的干馏属于物理变化 | |
| C. | 石油裂化的主要目的是除去石油中的杂质 | |
| D. | 压缩天然气和液化石油气的主要成分均为一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H4O | C. | C2H6 | D. | C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 甲 | 乙 | 丙 | ||
| 密闭容器体积/L | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率% | 80 | α1 | α2 | |
| A. | 该温度下,甲容器10min达到平衡,平均速率为v(SO3)=0.032 mol•L-1•min-1 | |
| B. | SO2的平衡转化率:α1<80% | |
| C. | 容器中SO3的物质的量浓度:2c(甲)>c(丙) | |
| D. | 甲中反应的平衡常数K为400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
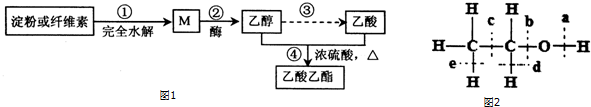
 CH3 CH2CO18OCH2CH3+H2O.
CH3 CH2CO18OCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率一定增大 | B. | 平衡一定向正反应方向进行 | ||
| C. | 反应物的转化率一定增大 | D. | 该反应的条件一定发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
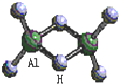 科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )
科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )| A. | Al2H6跟水的反应可能是氧化还原反应,产物之一可能是氢氧化铝 | |
| B. | Al2H6在空气中完全燃烧,产物为氧化铝和水 | |
| C. | Al2H6分子是极性分子 | |
| D. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com