
氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:O2+2CO2+4e-=2C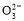 。下列叙述正确的是( )
。下列叙述正确的是( )
A.放电时C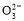 向正极移动
向正极移动
B.放电时OH-向负极移动
C.负极反应为H2+C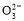 -2e-=H2O+CO2
-2e-=H2O+CO2
D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L 时,转移电子4 mol
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题17氮及其化合物练习卷(解析版) 题型:选择题
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
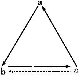
选项abc
AAlAlCl3Al(OH)3
BHNO3NONO2
CSiSiO2H2SiO3
DNH3NO2NO
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题13铁、铜及其重要化合物练习卷(解析版) 题型:选择题
已知酸性条件下有如下反应:2Cu+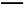 Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入 试剂 | 稀硫酸 | 浓硫酸、 加热 | 稀硝酸 | 浓硝酸 |
实验 现象 | 红色固体和 蓝色溶液 | 无色气体 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是( )
A.Cu B.一定有Cu,可能有Cu2O
C.Cu2O D.一定有Cu2O,可能有Cu
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:填空题
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备
甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成C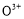 ,然后以C
,然后以C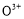 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
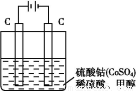
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3)∶n(CuSO4)=1∶9]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是( )
A.a电极与电源的负极相连
B.t2时,两电极的质量相差3.84 g
C.电解过程中,溶液的pH不断增大
D.t2时,b的电极反应是4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸的化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A.等浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HC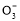 )+2c(C
)+2c(C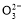 )
)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
25 ℃时,浓度为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是( )
A.存在电离平衡HC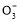
 H++C
H++C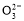
B.存在水解平衡HC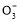 +H2O
+H2O H2CO3+OH-
H2CO3+OH-
C.将溶液加热蒸干、灼烧得Na2O2固体
D.加入NaOH固体,恢复到原温度,c(OH-)、c(C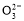 )均增大
)均增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOClCl)中形成的,其电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S。下列叙述中正确的是( )
A.电解质溶液可以用水,也可以用饱和食盐水
B.电池工作过程中,亚硫酰氯(SOCl2)被还原成Li2SO3
C.电池工作时,锂电极为正极,石墨电极为负极
D.电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
恒温、恒压下,a mol A和b mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) 2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
A.物质A、B的转化率之比为a∶b
B.当v正(A)=2v逆(B)时,可确定反应到达平衡状态
C.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b—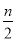 )
)
D.若起始时放入2a mol A和2b mol B,则达平衡时生成2n mol C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com