

| A. | 该分子中存在肽键 | |
| B. | 最多可以有12个碳原子共平面 | |
| C. | 1 mol氯雷他定最多可与8 mol氢气发生加成反应 | |
| D. | 能与NaOH溶液反应,但不能与NaHCO3溶液反应 |
分析 有机物含有酯基、-CO-N、-Cl以及碳碳双键等官能团,其中苯环为平面形结构,苯环、碳碳双键可与氢气发生加成反应,可发生水解反应,以此解答.
解答 解:A.含有-CO-N,但不是肽键,故A错误;
B.苯环、碳碳双键为平面形结构,且苯环连接在碳碳双键,共平面C原子数多于12,最多有16个,故B错误;
C.能与氢气发生加成反应的为苯环、碳碳双键以及C=N键,1 mol氯雷他定最多可与7 mol氢气发生加成反应,故C错误;
D.含有酯基,可与氢氧化钠发生反应而水解,但不含羧基,与碳酸氢钠不反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,注意把握有机物的官能团与性质的关系,熟悉烯烃、卤代烃的性质即可解答,选项B为难点,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤焦油干馏可得到苯、甲苯等 | |
| B. | 煤裂化可得到汽油、柴油、煤油等轻质油 | |
| C. | 石油分馏可得到乙烯、丙烯等重要化工产品 | |
| D. | 石油主要是各种烷烃、环烷烃和芳香烃组成的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
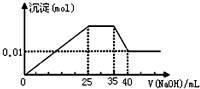 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-,现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )| A. | 原溶液一定不存在H+、Cu2+、CO32- | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH溶液浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | E1 | E2 | E3 | E4 |
| X | 522.05 | 7324.8 | 11856.6 | … |
| Y | 898.8 | 1763.58 | 14901.6 | 21084 |
| Z | 803.46 | 2436 | 3672.9 | 25116 |
| A. | X的原子电子层结构为1s22s1 | B. | Y为ⅡA族元素,其元素符号为Mg | ||
| C. | Z的价电子数为1 | D. | X的原子半径小于Y的原子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com