
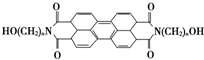
 ,当n=1时,其一氯代物(不考虑醇羟基被取代)可能有( )
,当n=1时,其一氯代物(不考虑醇羟基被取代)可能有( )| A、2种 | B、3种 | C、4种 | D、5种 |
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
| ||

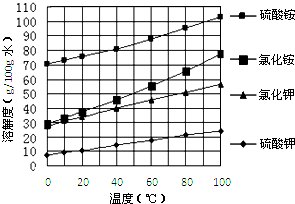
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
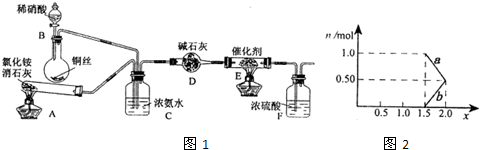
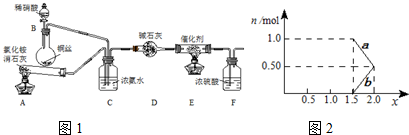
(10分)工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6NOx (2x+ 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
①装置A中发生反应的化学方程式为 ▲ 。
②装置C的作用是 ▲ 。
③装置F的作用是 ▲ 。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2+ CO2 (I)
2NO2 + Na2CO3 = NaNO2+ NaNO3 + CO2 (II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲ (填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx 通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:
图中线段a表示 ▲ 离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲ g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲ 。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com