
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
分析 (1)含有Na2SO4、NaCl中的一种或两种杂质,则可能为只有Na2SO4,只有NaCl,或Na2SO4、NaCl都有;
(3)检验碳酸钠可以和酸反应生成二氧化碳气体;
白色且不溶于硝酸的沉淀有硫酸钡和氯化银两种;
能和硝酸酸化的硝酸银反应生成白色沉淀的是含有氯离子的化合物,如加入硝酸钡生成沉淀,则说明含有Na2SO4.
解答 解:(1)含有Na2SO4、NaCl中的一种或两种杂质,则可能为只有Na2SO4,只有NaCl,或Na2SO4、NaCl都有,共3种,故答案为:3;
(3)①只有碳酸钠可以和酸反应生成二氧化碳气体,可以用硝酸检验是否生成二氧化碳气体来检验碳酸钠的存在;
②向酸化后的试管中加入0.1mol•L-1的Ba(NO3)2 溶液至过量,生成的白色且不溶于硝酸的沉淀是硫酸钡,证明含有硫酸钠;
③能和硝酸酸化的硝酸银反应生成的白色沉淀一定是氯化银,证明含有氯化钠,
故答案为:
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少许样品于试管中,加蒸馏水溶解.向试管中加足量的1.0 mol•L-1HNO3.(或加入1.0 mol•L-1HNO3至溶液中不再有气体放为止) | 有气体产生,说明样品中含有Na2CO3. |
| ② | 向试管中加入0.1 mol•L-1的Ba(NO3)2 溶液.若有沉淀产生,则继续加入0.1 mol•L-1Ba(NO3)2至过量. | 有沉淀产生,则含Na2SO4 |
| ③ | 将试管静置片刻后,取上层清液于另一去试管中,加入0.1 mol•L-1AgNO3溶液. | 有沉淀产生,则含NaCl. |
点评 本题考查物质检验、鉴别的实验方案的设计,侧重离子检验及实验探究的考查,注意混合物中一定存在、一定不存在和可能存在的是什么物质,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题
 ,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.
,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(5) | D. | (1)和(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 已知:K1 (H2CO3)>Ka (HClO)>K2(H2CO3),向NaClO溶液中通入少量CO2的化学方程是:2NaClO+CO2+H2O=Na2CO3+2HClO | |
| C. | 25℃时,pH=4的盐酸中,KW=10-20 | |
| D. | 常温下,Ksp(CaSO4)=9×10-6,向100mL饱和CaSO4溶液中加400mL 0.01mol/LNa2SO4溶液,无沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量氯气完全反应转移的电子数为0.2NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子均为0.2NA | |
| C. | 标准状况下,22.4 L CO2与22.4 L H2O所含原子数均为3 NA | |
| D. | 体积分别为1.0L pH=2的盐酸与硫酸溶液中氢离子数均为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2<H2O<SiO2<KCl | B. | 还原性:S2->I->Br->Cl- | ||
| C. | 酸性:H3PO4>H2SO4>HClO4>H2SiO3 | D. | 稳定性:H2O<NH3<PH3<SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
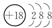 .
. 4NO+6H2O.
4NO+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com