
| A. | I-,Fe2+,Cl-,Mn2+ | B. | Cl-,Mn2+,I-,Fe2+ | ||
| C. | Mn2+,Cl-,I-,Fe2+ | D. | MnO4-,Cl2,Fe3+,I2 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数大于4的元素不一定是非金属元素 | |
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐减弱 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素不一定是金属元素 | |
| D. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
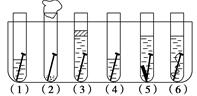 取6根铁钉、6支洁净试管及其他材料,按图所示准备.
取6根铁钉、6支洁净试管及其他材料,按图所示准备.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6 | B. | C2H6O | C. | C2H6O2 | D. | C3H6O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )
常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )| A. | 酸B比酸A的电离度大 | B. | A为弱酸,B为强酸 | ||
| C. | 酸B的物质的量浓度比A的小 | D. | A酸比B酸易电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com