
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |
| 1.8×10-11 |
| 8.1×10-9 | ||
|
| 8.1×10-9 | ||
|
| 1.8×10-11 |


科目:高中化学 来源: 题型:
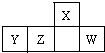 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
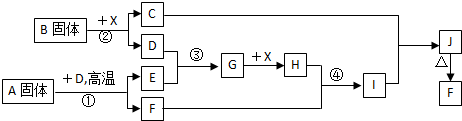
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用醋酸除去暖瓶中的水垢:2H++CaCO3═Ca2++CO2↑+H2O |
| B、利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- |
| C、氢氧燃料电池在酸性介质中的正极反应:O2+4e-+2H2O=4OH- |
| D、汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象 | 原因或结论 |
| A | 在 H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
| B | 向5mL 0.005mol?L-1FeCl3溶液中加入5mL 0.015mol?L-1KSCN溶液,溶液呈红色,再滴加几滴1mol?L-1KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
| C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 该反应△H<0,平衡向生成NO2方向移动 |
| D | 在密闭容器中有反应:A+xB(g)?2C(g).达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1 | A非气体、x=1 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L酒精含有的分子数约为1NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA |
| C、通常状况下,1NA个CO2分子占有的体积为22.4L |
| D、1NA氧原子的质量(以g为单位)在数值上约等于其相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH、Ca(OH)2、NH3?H2O |
| B、NH4Cl、CH3COOH、Na2S |
| C、HBr、HCl、BaSO4 |
| D、HClO、NaF、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、500 |
| B、600 |
| C、1 200 |
| D、1 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com