


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
①在A、B两溶液中分别加入强碱溶液,A无变化,B产生白色沉淀。
②在A、B两溶液中分别加入硫酸溶液,A产生不溶于酸的白色沉淀C,B产生微溶于水的物质D和无色无味能使澄清的石灰水变浑浊的气体E。
③将E通入A溶液中也产生白色沉淀C。
④A溶液焰色反应呈黄色,B和D的焰色反应均为砖红色。
则下列物质的化学式分别为:
A________,B________,C________,D________。
查看答案和解析>>
科目:高中化学 来源: 题型:
①写出下列物质的化学式:C__________,E__________。
②完成下列过程的离子方程式:A+硫酸____________________;B+硫酸___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E是同族元素,且D最外层电子数是次外层电子数的3倍。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。请回答下列问题(填空时用化学符号作答):
(1)BC-的电子式为 ;元素F在周期表中的位置为 。
![]() (2)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示。根据以上信息和数据,下列说法正确的是 。
(2)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示。根据以上信息和数据,下列说法正确的是 。
A.C4属于一种新型的化合物 B.C4与C2互为同素异形体
C.C4稳定性比P4(白磷)差 D.C4与C2互为同位素
(3)A与C两种元素可形成多种化合物分子,其中CA3分子的分子的空间构型为
,键角 ;C2A4分子的结构式为 。
(4)为了除去化合物A2ED4稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为 。
(5)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是
A.E2F2的结构式为:F-E—E-F B.E2F2在一定条件下,有氧化性或还原性
C.E2F2中的两各E原子的化合价分别为0价和+2价
D.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+ 3E↓+4HF
(6)B与D可形成两种常见化合物,其中一种化合物BD2是 分子(填“极性”或“非极性”)。在1000 mL 0.1 mol/L的 Ca(OH)2物质的水溶液中逐渐通入BD2并充分搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随通入BD2的物质的量的变化曲线。
 |
查看答案和解析>>
科目:高中化学 来源:2010年成都七中高一下学期期末考试化学 题型:填空题
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E是同族元素,且D最外层电子数是次外层电子数的3倍。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。请回答下列问题(填空时用化学符号作答):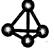
(1)BC-的电子式为 ;元素F在周期表中的位置为 。
(2)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示。根据以上信息和数据,下列说法正确的是 。
A.C4属于一种新型的化合物 B.C4与C2互为同素异形体
C.C4稳定性比P4(白磷)差 D.C4与C2互为同位素
(3)A与C两种元素可形成多种化合物分子,其中CA3分子的分子的空间构型为
,键角 ;C2A4分子的结构式为 。
(4)为了除去化合物A2ED4稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为 。
(5)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是
A.E2F2的结构式为:F-E—E-F B.E2F2在一定条件下,有氧化性或还原性
C.E2F2中的两各E原子的化合价分别为0价和+2价
D.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+ 3E↓+4HF
(6)B与D可形成两种常见化合物,其中一种化合物BD2是 分子(填“极性”或“非极性”)。在1000 mL 0.1 mol/L的 Ca(OH)2物质的水溶液中逐渐通入BD2并充分搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随通入BD2的物质的量的变化曲线。
 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市高三第二次教学质检检测理综化学试卷(解析版) 题型:填空题
氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:
下列有关该反应的叙述正确的是
A.正反应活化能小于169.8kJ·mol-1
B.逆反应活化能一定小于169.8kJ·mol-1
C.正反应活化能不小于169.8kJ·mol-1
D.正反应活化能比逆反应活化能小169.8kJ·mol-1
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是 。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系,如图1所示。在4000℃~5000℃时可能发生下列哪些反应 (填写字母)。


(4)制取氢气的另一种方法是电解尿素[CO(NH2)2]的碱性溶液,装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。该电解装置中电解排出液中的主要成分是 (写化学式)。
(5)已知下列物质的KSP:
5.6×10-12;Ca(OH)2;1.4×10-5。氯碱工业中 电解饱和食盐水也能得到氢气,电解所用的盐水需精制,去除有影响的Ca2+、Mg2+、NH4+、SO42— [c(SO42—)>c(Ca2+)]。某精制流程如下:

①盐泥a除泥沙外,还含有的物质是 。
②过程I中将NH4+转化为N2的离子方程式是 。
③过程II中除去的离子有 。
④经过程III处理,需求盐水c中剩余Na2SO3的含量小于5mg/L。若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,至多添加10%Na2SO3溶液 kg(溶液体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com