
| A. | 常温常压下,32 g O2含有氧原子数为NA | |
| B. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| C. | 18g H2O中含有的电子数为10NA | |
| D. | 0.5mol•L-1CaCl2溶液中含Cl-数目为NA |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
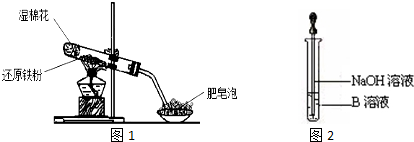
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,反应类型取代反应
,反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:填空题
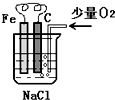 分析图,按要求写出有关反应方程式:
分析图,按要求写出有关反应方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗NaOH溶液20mL | |
| B. | 溶液的PH值一定恰好等于7 | |
| C. | 溶液中只有醋酸钠 | |
| D. | 反应后溶液中醋酸根离子的浓度与钠离子溶液相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com