
| A£®ÉżøßĪĀ¶Č | B£®¼ÓČė“߻ƼĮ | C£®½«XQ3¼°Ź±·ÖĄė³öČ„ | D£®Ōö“ó·“Ó¦ĢåĻµµÄŃ¹Ēæ |
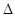 H=£393.5kJ/mol
H=£393.5kJ/mol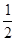 Y2£Øg£©=WY2£Øg£©£»
Y2£Øg£©=WY2£Øg£©£»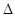 H=£238.0kJ/mol”£Ōņ 24g WÓėŅ»¶ØĮæµÄY2·“Ó¦£¬·Å³öČČĮæ362.5 kJ£¬ĖłµĆ²śĪļ³É·Ö¼°ĪļÖŹµÄĮæÖ®±ČĪŖ ”£
H=£238.0kJ/mol”£Ōņ 24g WÓėŅ»¶ØĮæµÄY2·“Ó¦£¬·Å³öČČĮæ362.5 kJ£¬ĖłµĆ²śĪļ³É·Ö¼°ĪļÖŹµÄĮæÖ®±ČĪŖ ”£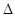 H=£155.5kJ/mol”£
H=£155.5kJ/mol”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ķ¼1±ķŹ¾KNO3µÄČܽā¶ČĒśĻߣ¬aµćĖłŹ¾µÄČÜŅŗŹĒ80”ꏱKNO3²»±„ŗĶČÜŅŗ |
| B£®Ķ¼2±ķŹ¾Ä³·ÅČČ·“Ó¦·Ö±šŌŚÓŠ”¢ĪŽ“߻ƼĮµÄĒéæöĻĀ·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ |
| C£®Ķ¼3±ķŹ¾0.1000mol/LNaOHµĪ¶Ø20.00 mL 0.1000mol/L“×ĖįµÄµĪ¶ØĒśĻß |
| D£®Ķ¼4±ķŹ¾ĻņNH4Al(SO4)2ČÜŅŗÖŠÖšµĪµĪČėBa(OH)2ČÜŅŗ£¬Ģå»żVÓė³ĮµķnµÄ±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 N2(g)+2H2O(l) ”÷H="-a" kJ/mol
N2(g)+2H2O(l) ”÷H="-a" kJ/mol CuO(s)+H2O(l) ”÷H="b" kJ/mol
CuO(s)+H2O(l) ”÷H="b" kJ/mol 2Cu2O(s)+O2(g) ”÷H="c" kJ/mol
2Cu2O(s)+O2(g) ”÷H="c" kJ/mol Cu2O+H2”ü£¬ŌņŃō¼«·“Ó¦Ź½ĪŖ£ŗ ”£
Cu2O+H2”ü£¬ŌņŃō¼«·“Ó¦Ź½ĪŖ£ŗ ”£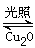 2H2(g)£«O2(g) ”÷H£½£«484 kJ”¤mol£1
2H2(g)£«O2(g) ”÷H£½£«484 kJ”¤mol£1| Ź±¼ä/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 1.0 | 1.6 | 2.0 | 2.0 |


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ä³·“Ó¦µÄģŹ±äŠ”ÓŚĮć£¬øĆ·“Ó¦Ņ»¶ØÄÜ×Ō·¢½ųŠŠ |
| B£®ÓĆŹŖČóµÄpHŹŌÖ½²āĻ”ŃĪĖįČÜŅŗµÄpHĪŖ3.52 |
| C£®²ŻÄ¾»Ņ£ØK2CO3£©ŹĒ¼Ų·Ź£¬ĮņĖįļ§ŹĒµŖ·Ź£¬¶žÕß»ģŗĻŹ©ÓĆæÉŅŌĢįøß·ŹŠ§ |
| D£®Ōµē³ŲŹĒ½«»ÆѧÄÜ×Ŗ±äĪŖµēÄܵÄ×°ÖĆ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 CH3OH(g) ¦¤H£¬
CH3OH(g) ¦¤H£¬
| A£®ĻņÕż·½ĻņŅĘ¶Æ | B£®ĻņÄę·½ĻņŅĘ¶Æ | C£®“¦ÓŚĘ½ŗāדĢ¬ | D£®ĪŽ·ØÅŠ¶Ļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
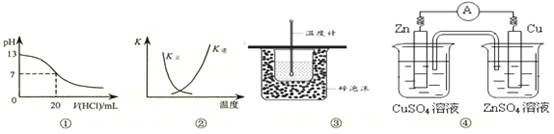
| A£®Ķ¼¢Ł±ķŹ¾25”ꏱ£¬ÓĆ0.1 mol”¤L£1ŃĪĖįµĪ¶Ø20 mL 0.1 mol”¤L£1 NaOHČÜŅŗ£¬ČÜŅŗµÄpHĖę¼ÓČėĖįĢå»żµÄ±ä»Æ |
B£®Ķ¼¢ŚÖŠĒśĻß±ķŹ¾·“Ó¦2SO2(g) + O2(g)  2SO3(g)£»¦¤H < 0 Õż”¢Äę·“Ó¦µÄĘ½ŗā³£ŹżKĖęĪĀ¶ČµÄ±ä»Æ 2SO3(g)£»¦¤H < 0 Õż”¢Äę·“Ó¦µÄĘ½ŗā³£ŹżKĖęĪĀ¶ČµÄ±ä»Æ |
| C£®Ķ¼¢Ū×°ÖĆÓĆÓŚ²ā¶ØÖŠŗĶČČ |
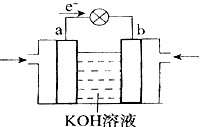
| D£®Ķ¼¢Ü×°ÖĆæÉŅŌ¹¹³ÉŠæ”¢Ķ”¢ĮņĖįĶČÜŅŗŌµē³Ų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®¢Ł¢Ś¢Ü¢Ż | B£®¢Ł¢Ü¢Ż¢Ž | C£®¢Ś¢Ū¢Ż¢Ž | D£®¢Ł¢Ś¢Ü¢Ż¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 Ķ¼¢Ś
Ķ¼¢Ś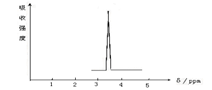
| A£®CH3CH3 | B£®CH3COOH | C£® CH3COOCH3 | D£® CH3OCH3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com