
| A. | 将100mL 0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.0l NA | |
| B. | Na2O2与足量的水反应生成1 molO2,转移电子数目为2 NA | |
| C. | 某密闭容器中有2mo1SO2和1mol O2,在一定条件下充分反应,转移的电子数为4 NA | |
| D. | 18g重水(D2O)所含的电子数为1 NA |
分析 A.氢氧化铁胶体微粒是氢氧化铁的集合体;
B.Na2O2与H2O的反应2Na2O2+2H2O=4NaOH+O2↑,此反应转移2mol电子,生成1molO2;
C.二氧化硫与氧气反应为可逆反应;
D.质量转化为物质的量,结合1个D2O含有10个电子.
解答 解:A.氢氧化铁胶体微粒是氢氧化铁的集合体,将100mL 0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目小于0.0l NA,故A错误;
B.Na2O2与足量的水反应生成1 molO2,转移电子数目为2 NA,故B正确;
C.二氧化硫与氧气反应为可逆反应,可逆反应不能进行到底,所以2mo1SO2和1mol O2,不能完全反应,转移电子数为小于4 NA,故C错误;
D.18g重水(D2O)物质的量为$\frac{18g}{20g/mol}$=0.9mol,所含的电子数为0.9NA,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数的有关计算和判断,熟练掌握公式和物质的组成和结构是关键,注意可逆反应不能进行到底的特点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ | |
| C. | HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度 | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱溶液保存在带玻璃塞的试剂瓶中 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 浓硝酸保存在棕色细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
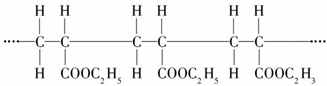
| A. | 其单体是CH2=CH2和HCOOC2H5 | B. | 这是缩聚反应产物 | ||
| C. | 其链节是CH3CH2-COOC2H5 | D. | 其单体是CH2=CH-COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al(OH)3是两性氢氧化物 | |
| B. | 因为Al2O3是金属氧化物,所以它是碱性氧化物 | |
| C. | Al(OH)3能凝聚水中悬浮物,也能吸附色素 | |
| D. | Al(OH)3既溶于NaOH溶液、氨水,又能溶于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5×10-7 mol•L-1 | B. | 1.0×10-7 mol•L-1 | ||
| C. | $\frac{1×1{0}^{-14}}{2.5×1{0}^{-7}}$mol•L-1 | D. | 无法确定c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用CCl4萃取溴水中的溴单质 | |
| D. | 称量时称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com