
| A.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=+285.8KJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)==2CO(g)+O2(g)反应的 △H=2×283.0kJ/mol |
C.在稀溶液中H+(aq)+OH-(aq)  H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ H2O(l) △H=-57.2 kJ/mol 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.2 kJ |
D.己知2H2(g)+O2(g) 2H2O(l)△H1 , 2H2O(l)△H1 , |
 2H2O(g)△H2 , 则△H1 > △H2
2H2O(g)△H2 , 则△H1 > △H2 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.②③ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g)ΔH=-867kJ·mol-1 |
| B.CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(l)ΔH3>ΔH1 |
| C.若用0.2mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH =+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH =-1 452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH =-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH =+1 452 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
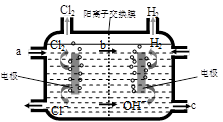
 B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
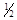 O2(g)==H2O(g);△H3,则△H1、△H2和△H3的关系是
O2(g)==H2O(g);△H3,则△H1、△H2和△H3的关系是 | A.△H1=△H2=△H3 | B.△H1 > △H2,△H1=2△H3 |
| C.△H1 < △H2,△H2=2△H3 | D.无法比较 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ·mol-1 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 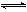 2NH3(g)△H= -38.6kJ·mol-1 2NH3(g)△H= -38.6kJ·mol-1 |
| C.1 g H2完全燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式为: H2(g)+1/2O2(g)="=" H2O( l ) ΔH=-142.9 kJ·mol-1 |
| D.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g) ΔH =" Q" kJ/mol
C(g)+D(g) ΔH =" Q" kJ/mol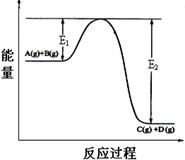
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
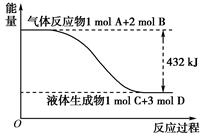
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com