
| A. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| B. | PM2.5是指大气中直径接近2.5×l0-6m的颗粒物,分散在空气中形成胶体 | |
| C. | 石英用于生产光导纤维和计算机芯片 | |
| D. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 |
分析 A.焰色反应是元素的性质;
B.胶体的分散系中分散质的直径在1~100nm;
C.石英用于生产光导纤维,硅用于生产计算机芯片;
D.食盐消毒液消毒是因为可以使蛋白质变性.
解答 解:A.焰火的五彩缤纷是焰色反应,是某些金属元素的焰色反应,故A正确;
B.胶体的分散系中分散质的直径在1~100nm,PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,直径大于100nm,则细颗粒物分散在空气中形成的分散系不是胶体,故B错误;
C.石英用于生产光导纤维,硅用于生产计算机芯片,故C错误;
D.食盐消毒液消毒是因为可以使蛋白质变性,而并非是将病毒氧化,而次氯酸钠溶液可以将病毒氧化而达到消毒的目的,故D错误.
故选A.
点评 本题考查焰色反应、胶体的性质、石英和硅的用途以及消毒剂等,题目难度不大,平时注意知识的积累.


科目:高中化学 来源: 题型:解答题

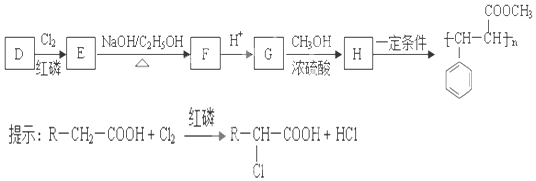
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | Na2O2和CO2的反应中,每有1molNa2O2参加反应转移电子数为2NA | |
| D. | 16 gO2分子和16 gO3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
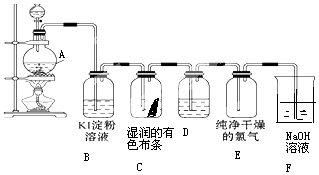
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 分别加水稀释10倍,四种溶液的pH①>②>④>③ | |
| B. | ①加入适量的氯化铵晶体后,溶液的pH减小 | |
| C. | ①溶液中c(NH4+)+c(H+)大于④中的c(Cl-)+c(OH-) | |
| D. | VaL④与VbL②溶液混合后,若混合后溶液PH=4,则Va:Vb=11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通锌锰干电池中的MnO2在工作时起催化作用 | |
| B. | lmol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023 | |
| C. | 室温下,体积、pH均相同的HA和HB两种一元酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | 恒温恒压密闭容器中反应N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1达到平衡时,向容器中再充入一定量NH3,重新达平衡时a值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
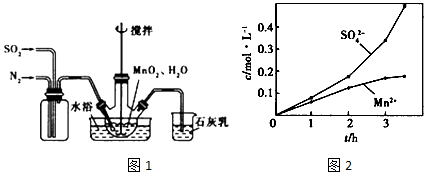
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com