
下列各离子方程式都不正确,试指出错误的原因并写出正确的离子方程式.
①FeBr2溶液中滴入足量的氯水
2Fe2++Cl2=2Fe2++2Cl-
②向NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性
H++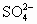 +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
③(NH4)2SO4溶液与Ba(OH)2溶液混合
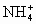 +OH-+
+OH-+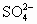 +Ba2+=NH3↑+H2O+BaSO4↓
+Ba2+=NH3↑+H2O+BaSO4↓
④Ca(HCO3)2溶液中加入大量NaOH溶液
Ca2++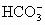 +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
|
【答案】①2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- ②2H++ ③2 ④Ca2++2 【解析】①FeBr2电离出的Fe2+和Br-都能被Cl2氧化,当Cl2足量时,这两者应以1∶2的比例与Cl2反应. ②1mol NaHSO4可电离出1mol H+,而Ba(OH)2为二元强碱,1mol可电离出2mol OH-,当NaHSO4和Ba(OH)2物质的量比为2∶1时,反应后溶液呈中性,即:2H++ ③铵盐和强碱溶液混合后要加热才能逸出氨气,此反应没有反应条件,而且离子方程式中的化学计量数不符合化学式中的物质组成. ④1mol Ca(HCO3)2应电离出1mol Ca2+和2mol Ca2++2 若在Ca(HCO3)2溶液中加入少量NaOH溶液,那么Ca(HCO3)2不能完全反应,离子方程式为: Ca2++ |


 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
 A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- |
K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
查看答案和解析>>
科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:043
下列各离子方程式都不正确,试指出错误的原因并写出正确的离子方程式.
1.向FeBr2溶液中滴入足量的氯水
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
2.向NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性
H++![]() +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
3.(NH4)2SO4溶液跟Ba(OH)2稀溶液混合
![]() +OH-+
+OH-+![]() +Ba2+=NH3↑+H2O+BaSO4↓
+Ba2+=NH3↑+H2O+BaSO4↓
4.碳酸氢钙溶液中加入大量氢氧化钠溶液
Ca2++![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
①向FeBr2溶液中滴入足量的氯水
2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-
②向NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性
H++SO![]() +Ba2++OH-====BaSO4↓+H2O
+Ba2++OH-====BaSO4↓+H2O
③(NH4)2SO4溶液跟Ba(OH)2稀溶液混合
NH+4+OH-+SO![]() +Ba2+====NH3↑+H2O+BaSO4↓
+Ba2+====NH3↑+H2O+BaSO4↓
④碳酸氢钙溶液中加入大量氢氧化钠溶液
Ca2++HCO![]() +OH-====CaCO3↓+H2O
+OH-====CaCO3↓+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com