
某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| | 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 | | | | |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。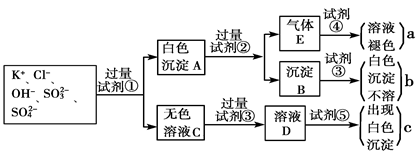
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(17分)铁及其化合物在日常生活、生产中应用广泛。氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol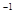 ;
;
②C(石墨)+CO2(g) 2CO(g)△H=+172.5KJ·mol
2CO(g)△H=+172.5KJ·mol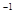 ;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)
;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H= KJ·mol
2Fe(s)+3CO2(g)△H= KJ·mol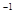 。
。
(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为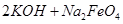 =
=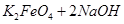 ,说明此温度下
,说明此温度下 __________
__________ 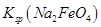 (填“>”或“<”)。
(填“>”或“<”)。
假定此过程中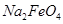 完全转化为
完全转化为 ,若最终制得粗产品
,若最终制得粗产品 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(2)实验③中的现象为 。
(3)实验①、②中反应的离子方程式分别是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3—、SO42— |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是: 。
(2)A、C形成的四原子核化合物甲的电子式为 ,该化合物呈弱酸性,试写出这种化合物的电离方程式: 。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式: 。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式: 。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式: 。
(6)A、E形成的四原子核化合物丙容易液化,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是 ,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 序号 | 实验内容 | 实验结果 |
| 1 | 加过量盐酸 | 无气体产生 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 第一次称量读数为2.33 g |
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1 L某混合溶液,可能含有的离子如下表。
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com