
| -1214.6kJ |
| mol |
| 1 |
| 2 |
| +283kJ |
| mol |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| △c |
| △t |
| 1 |
| 2 |
| ||
| 5min |
| 1.6×1.6 |
| 0.4×2.4 |
| 8 |
| 3 |
| 0.4×0.4 |
| 0.6×1.6 |
| 1 |
| 6 |


科目:高中化学 来源: 题型:
| A、试管塞越来越紧,是因为反应消耗了大量O2 |
| B、打开试管塞前Cu元素的化合价为+1价 |
| C、溶液迅速变为蓝色溶液,是因为反应生成了[Cu(H2O)4]2+ |
| D、上述反应原理可用于测定O2的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、29mn | ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、消耗的硝酸的量:①>②>③ |
| B、铜与浓硝酸作用最快,故最佳方案是① |
| C、对环境造成的危害,③最小 |
| D、三种途径所消耗的铜的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 硫酸铜/g | 14.8 | 20.5 | 28.5 | 39.6 | 53.6 | 73.0 |
| 硝酸铜/g | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
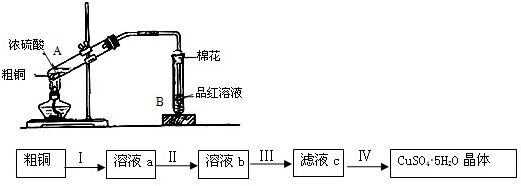
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
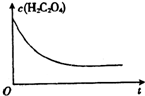 某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.
某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色所需时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 4 | ||
| 3 | 60 | 25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com