
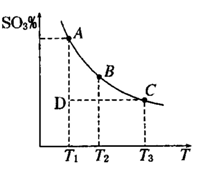
 2SO3��g���������ϵ��SO3 �İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣬
2SO3��g���������ϵ��SO3 �İٷֺ������¶ȵĹ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������ͼʾ�ش��������⣬ 2SO3��g���ġ�H 0
2SO3��g���ġ�H 0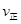
 ���>����<����=����
���>����<����=����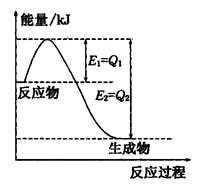
 2NH3(g)��H=2(Q1-Q2)KJ/mol (3��)
2NH3(g)��H=2(Q1-Q2)KJ/mol (3��)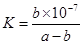 ��1�֣�
��1�֣� 2NH3(g) ��H=2(Q1-Q2)KJ/mol ��
2NH3(g) ��H=2(Q1-Q2)KJ/mol ��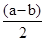 ,c��NH4����=c��Cl�D��=
,c��NH4����=c��Cl�D��=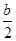 mol/L,c��H����=c��OH����=10-7mol/L,
mol/L,c��H����=c��OH����=10-7mol/L,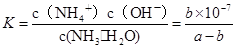 ,�𰸣�=��
,�𰸣�=��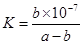


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2CO2(g)+ N2(g)����H��0
2CO2(g)+ N2(g)����H��0
 N2O4(g) ��H����56.9 kJ/mol
N2O4(g) ��H����56.9 kJ/mol 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 SO3(g)+NO(g)�������Ϊ1��2��NO2��SO2���������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
SO3(g)+NO(g)�������Ϊ1��2��NO2��SO2���������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� �� CH3OH(g)��H2O(g) ��H3
CH3OH(g)��H2O(g) ��H3


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��S��s�����+O2��g��=SO2��g����H ="+297.16" kJ?mol-1 |
| B��S��s�����+O2��g��=SO2��g����H ="-296.83" kJ?mol-1 |
| C��S��s��������+O2��g��=SO2��g����H ="-296.83" kJ?mol-1 |
| D����б�����������ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ���ķ�Ӧ�Ȧ�HΪ �� ��
���ķ�Ӧ�Ȧ�HΪ �� ��| A��-1780kJ��mol��1 | B��-1220kJ��mol��1 | C��-450kJ��mol��1 | D��+430kJ��mol��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2CO2(g)+ N2(g)����H��0
2CO2(g)+ N2(g)����H��0
 N2O4(g) ��H����56.9 kJ/mol
N2O4(g) ��H����56.9 kJ/mol 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g������H=-90.8kJ��mol��1
CH3OH��g������H=-90.8kJ��mol��1 CH3OCH3��g��+H2O��g������H=-23.5kJ��mol��1
CH3OCH3��g��+H2O��g������H=-23.5kJ��mol��1 CO2��g��+H2��g������H=-41.3kJ��mol��1
CO2��g��+H2��g������H=-41.3kJ��mol��1 CH3OCH3��g��+CO2��g���ġ�H= ��
CH3OCH3��g��+CO2��g���ġ�H= ��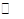 CH3OCH3��g��+H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400��
CH3OCH3��g��+H2O(g)ij�¶��µ�ƽ�ⳣ��Ϊ400��| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol?L�� | 0.44 | 0.6 | 0.6 |
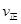 _______
_______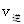 ���>������<����=������
���>������<����=�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 O2(g)=HNO2(aq)+H+(aq)+H2O(1) ��H="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ��H="-b" KJ/mol| A����NH4+ת��ΪNO3-���Ȼ�ѧ����ʽ�ɱ�ʾΪ�� NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)��H=-(b+  )KJ/mol )KJ/mol |
| B������������ת�������У���ˮ������������Ȼ������ |
| C�������£���HNO3��Һ��c(H+)="0.1" mol��L-1�������Һ��pH>1 |
| D������������ת����ȫ�������������������ӵĴ��ڣ���c(NH4+)+c(OH-)=c(NO3-)+c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 BaCO3(s)+SO42��(aq)
BaCO3(s)+SO42��(aq)�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com