
| A. | 溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液、振荡、静置分层后,除去水层 | |
| C. | 除去乙酸乙酯中少量的乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
分析 A.溴可与氢氧化钠溶液反应;
B.苯酚与氢氧化钠溶液反应;
C.乙醇与乙酸的反应为可逆反应;
D.乙醛在碱性条件下解热被氢氧化铜氧化.
解答 解:A.溴与NaOH溶液反应后与溴苯分层,则溴苯中含有溴单质,可用NaOH溶液洗涤,再经分液而除去,故A正确;
B.,苯不溶于水,苯酚与氢氧化钠溶液反应,可分液分离,故B正确;
C.乙醇与乙酸的反应为可逆反应,应加入饱和碳酸钠溶液除杂,故C错误;
D.乙醛与新制Cu(OH)2悬浊液反应时需要在碱性条件下进行,应用硫酸铜溶液与过量的氢氧化钠溶液反应,故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的制备、混合物分离提纯等,侧重实验基本操作和反应原理的考查,选项B为易错点,注意实验操作的评价性分析,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去KNO3中混杂的NaCl | 重结晶 | 氯化钠在水中的溶解度很大 |
| D | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 0.5 mol•L-1MgCl2溶液 | B. | 200mL 1.5 mol•L-1CaCl2溶液 | ||
| C. | 50mL 1 mol•L-1NaCl溶液 | D. | 25mL 0.5 mol•L-1vHCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol | B. | 4mol | C. | 5mol | D. | 10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
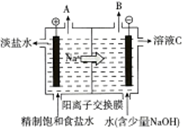 电解饱和食盐水的原理如图所示.
电解饱和食盐水的原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列两种方案制备氢氧化铝
下列两种方案制备氢氧化铝 | A. | 方案二比方案一生成更多的气体 | |
| B. | a曲线表示的是向Y溶液中加入稀盐酸溶液 | |
| C. | 在M点时,两种方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com