
| A. | 若a=b且c(X-)=c(Y-)+c(HY),则HX为强酸 | |
| B. | 若a=b且pH(NaX)>pH(NaY),则c(X-)+c(OH-)>c(Y-)+c(OH-) | |
| C. | 若a>b且c(X-)=c(Y-),则酸性HX>HY | |
| D. | 若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化) |
分析 A.完全电离的酸是强酸;
B.根据电荷守恒和物料守恒判断;
C.酸的酸性越强,其酸根离子的水解能力越小;
D.根据物料守恒判断.
解答 解:A.若a=b,且c(X-)=c(Y-)+c(HY),说明HX完全电离,所以能说明HX为强酸,故A正确;
B.若a=b且 pH(NaX)>pH(NaY),根据电荷守恒得c(Na+)+c(H+)=c(X-)+c(OH-),c(Na+)+c(H+)=c(Y-)+c(OH-),根据物料守恒得两种溶液中c(Na+)相等,根据溶液的PH知,X-的水解程度大于Y-,所以NaX中氢离子浓度小于NaY,所以c(X-)+c(OH-)<c(Y-)+c(OH-),故B错误;
C.若a>b且c(X-)=c(Y-),说明X- 的水解程度大于Y-,酸根离子水解程度越大,其相应酸的酸性越弱,则酸性HX<HY,故C错误;
D.若两溶液等体积混合,钠离子不水解,但溶液体积增大一倍,所以则c(Na+)=$\frac{a+b}{2}$mol/L,故D错误;
故选A.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点及弱酸酸性强弱与酸根离子水解程度的关系是解本题关键,易错选项是D,注意溶液体积变大,为易错点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
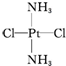 ,黄绿色固体
,黄绿色固体 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
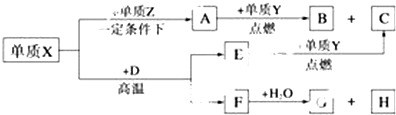
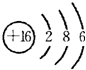 ,A的电子式
,A的电子式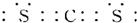 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
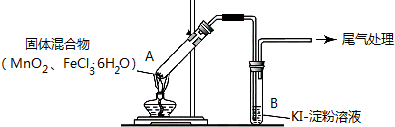
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
| 方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B中KI淀粉溶液替换为NaBr溶液;检验 Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com