
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.分析 (1)如HA是HCN,反应后为等浓度的HCN、NaCN的混合溶液,根据溶液呈电中性的角度比较离子浓度大小;
如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度;
(2)氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,一水合氨是弱电解质,相同浓度的溶液中一水合氨中铵根离子浓度最小;
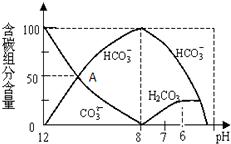
(3)①根据图判断C元素存在形式;
②酸性条件下,能存在大量碳酸,碱性条件下,能存在大量碳酸根离子;
③常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,先反应生成碳酸氢钠,再与盐酸反应生成二氧化碳、水,以此分析解答.
解答 解:(1)如HA是HCN,反应后为等浓度的HCN、NaCN的混合溶液,根据溶液电中性原则可知c(Na+)+c(H+)=c(CN-)+c(OH-),由于c(Na+)>c(CN-),则c(H+)<c(OH-);如HA是CH3COOH,反应后为等浓度的CH3COOH、CH3COONa的混合溶液,该混合溶液呈酸性,说明醋酸的电离程度大于醋酸根的水解程度,则c(CH3COOH)<c(CH3COO-),
故答案为:<;<;
(2)氢离子抑制铵根离子水解、醋酸根离子促进铵根离子水解,一水合氨是弱电解质,相同浓度的溶液中一水合氨中铵根离子浓度最小,浓度相等的这几种溶液中铵根离子浓度大小顺序是②>①>④>③,故答案为:②>①>④>③;
(3)①根据图知,人体血液的pH约为7.4,则CO2在血液中多以HCO3-的形式存在,故答案为:HCO3-.
②H2CO3是二元弱酸,分步电离,电离方程式为:H2CO3?H++HCO3-,HCO3-?H++CO32-,HCO3-分别与H2CO3、CO32-都能共存,酸性条件下,能存在大量碳酸,碱性条件下,存在大量碳酸根离子,因为二者存在环境不同,所以H2CO3和CO32-在溶液中不能大量共存,
故答案为:不能;
③水解常数Kh=2×10-4,当溶液中c(HCO3-):c(CO32-)=20:1时,c(OH-)=10-3mol/L,由Kw可知,c(H+)=10-9mol/L,所以pH=9,故答案为:9.
点评 本题考查弱电解质的电离和盐类水解,侧重考查学生分析判断及识图能力,明确弱电解质电离及盐类水解原理是解本题关键,难点是(2)题离子浓度大小比较,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
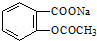 转变为
转变为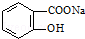 的方法为( )
的方法为( )| A. | 溶液加热,通入足量的HCl | |
| B. | 与足量的NaOH溶液共热后,再通入CO2 | |
| C. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-6 mol•L-1的溶液一定呈酸性 | |
| B. | PH=7的溶液一定呈中性 | |
| C. | c(OH-)=c(H+)的溶液一定呈中性 | |
| D. | 不能使酚酞试液变红的溶液一定呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水稀释后,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 | |
| D. | 对N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明的溶液中:Na+、Cu2+、SO42-、Cl- | |
| B. | pH=1的溶液中:Al3+、Mg2+、S2O32-、AlO2- | |
| C. | 能使酚酞变红色的溶液中:Fe3+、Ba2+、HC2O4-、Cl- | |
| D. | 常温下,水电离的c(OH-)=1×10-12mol•L-1溶液中:NH4+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 112.4 (100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
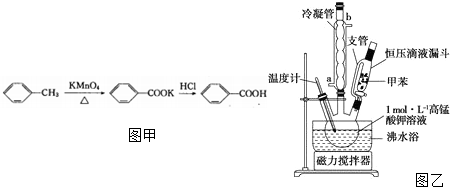
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
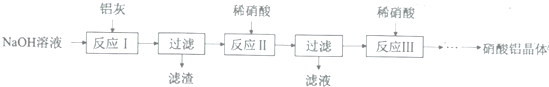
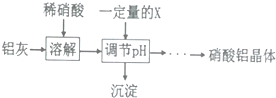
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com