
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________。
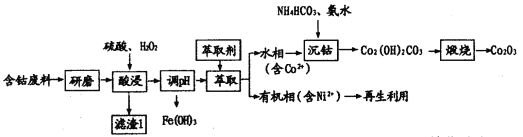
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH。则放电时正极的电极反应式为__________。
NiOOH+MH。则放电时正极的电极反应式为__________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
【答案】增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分 MnO2 亚铁离子氧化为铁离子 Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O 分液漏斗、烧杯 NiOOH+e-+H+= Ni(OH)2 2 Co2++HCO3-+3NH3H2O= Co2(OH)2CO3+3NH4++H2O 2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O
2Co2O3+2CO2+2H2O
【解析】
含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3;先把原料进行酸浸,MnO2与稀硫酸不反应,成为滤渣;滤液中含有Co2+、Co3+、Ni2+、Fe2+、Fe3+等离子;调整溶液的pH,铁离子生成沉淀滤出;再把滤液进行萃取,含有Ni2+的物质进入有机相,水溶液中含有Co2+,然后加入碳酸氢铵和氨水,反应生成Co2(OH)2CO3,然后煅烧生成Co2O3,据以上分析进行解答。
(1)研磨的目的是增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分;根据流程可知,铁离子变为氢氧化铁,镍离子进入有机相,水溶液中含有Co2+,经过一系列过程,最后得到氧化钴,所以滤渣1的主要成分为MnO2;综上所述,本题答案是:增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分;MnO2。
(2)酸浸时,加入双氧水能够把亚铁离子氧化为铁离子;Co2O3与盐酸发生氧化还原反应生成Cl2,Co Cl2和水,该反应的离子方程式为:Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O;综上所述,本题答案是:亚铁离子氧化为铁离子;Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O。
(3)在实验室里,萃取操作要用到的玻璃仪器主要有分液漏斗、烧杯;电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH,放电时正极发生还原反应,所以正极的电极反应式为:NiOOH+e-+H+= Ni(OH)2;综上所述,本题答案是:分液漏斗、烧杯;NiOOH+e-+H+= Ni(OH)2。
NiOOH+MH,放电时正极发生还原反应,所以正极的电极反应式为:NiOOH+e-+H+= Ni(OH)2;综上所述,本题答案是:分液漏斗、烧杯;NiOOH+e-+H+= Ni(OH)2。
(4)根据流程可知:含有Co2+离子的溶液中加入碳酸氢铵和氨水,反应生成Co2(OH)2CO3;沉钴时发生反应的离子方程式为:2 Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;在空气中煅烧Co2(OH)2CO3,反应生成Co2O3和CO2,化学方程式为:2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O;综上所述,本题答案是:2Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;2Co2(OH)2CO3+O2
2Co2O3+2CO2+2H2O;综上所述,本题答案是:2Co2++HCO3-+3NH3H2O=Co2(OH)2CO3+3NH4++H2O;2Co2(OH)2CO3+O2![]() 2Co2O3+2CO2+2H2O 。
2Co2O3+2CO2+2H2O 。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的叙述错误的是
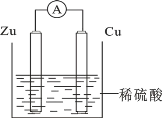
A. 锌是负极,其质量逐渐减小
B. 氢离子在铜表面得e-
C. 电子从锌片经导线流向铜片
D. 电流从锌片经导线流向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学选3——物质结构与性质)利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________,其单电子数为_________________。
(2)C、N、O、Mn电负性由大到小的顺序是___________。
(3)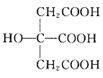 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______;该物质中不存在的作用力有_____。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
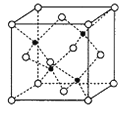
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,![]() 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如下图所示,下列说法正确的是
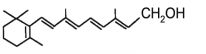
A. 1mol维生素A最多能与7molH2发生加成反应
B. 维生素A不能被氧化得到醛
C. 维生素A是一种易溶于水的醇
D. 维生素A的分子式为C20H30O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,下列说法正确的是 (已知AgCl 的Ksp=1.8×10-10 )
A.有AgCl沉淀析出B.无AgCl沉淀析出
C.无法确定有无AgCl沉淀析出D.有沉淀但不是AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学设计用分子筛催化CH4还原NO2并检验还原产物。回答下列问题:
(1)甲组同学设计用如图所示装置分别制备CH4和NO2。
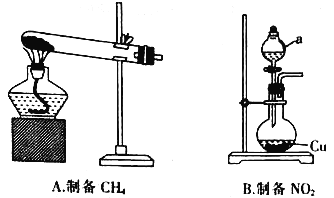
①在加热条件下,无水CH3 COONa与NaOH(CaO为催化剂)生成CH4和Na2CO3的化学方程式为___________。
②仪器a的名称为__________,仪器a中的药品是__________(填名称)。__________(填“能”或“不能”)用铁代替圆底烧瓶中的铜。
(2)乙组同学利用甲组制得的干燥气体并利用下列装置用CH4还原NO2
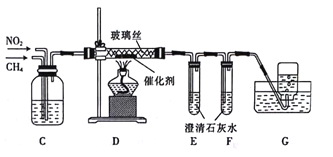
①C装置的作用是______________(列举2点)。
②D装置反应管中盛放玻璃丝的目的是___________;CH4与NO2生成N2和CO2的化学方程式为_____________。
③E装置中澄清石灰水未变浑浊,F装置中澄清石灰水变浑浊,其原因可能是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com