
| 物质 | CH3OH | CH3OCH3 | H2O |
| t1 | 0.8 | 1.24 | 1.24 |
| t2 | 0.08 | 1.6 | 1.6 |
| A. | 平衡后升高温度,平衡常数>400 | |
| B. | t2时刻反应达到平衡状态 | |
| C. | 平衡时,反应混合物的总能量减少20kJ | |
| D. | 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
分析 A.该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低;
B.由表中数据,代入Qc=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$计算;
C.反应混合物的总能量减少等于反应放出的热量,根据B计算中可知生成的n(CH3OCH3),结合热化学方程式计算放出的热量;
D.平衡时,再加入与起始等量的CH3OH,等效为增大压强,反应前后气体的物质的量不变,与原平衡等效,平衡后CH3OH转化率不变.
解答 解:A.该反应正反应是放热反应,升高温度平衡向逆反应进行,平衡常数降低,故平衡后升高温度,平衡常数<400,故A错误;
B.由表中数据可知,t2时刻CH3OH的浓度为0.08mol/L,CH3OCH3的浓度为1.6mol/L,H2O的浓度为1.6mol/L,所以Qc=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{1.6×1.6}{0.0{8}^{2}}$=400=K,说明反应达到平衡状态,故B正确;
C.反应混合物的总能量减少等于反应放出的热量,由B中可知,平衡时后c(CH3OCH3)=1.6mol/L,所以平衡时n(CH3OCH3)=1.6mol/L×1L=1.6mol,由热化学方程式可知反应放出的热量为25kJ/mol×1.6mol=40kJ,故平衡时,反应混合物的总能量减少40kJ,故C错误;
D.平衡时,再加入与起始等量的CH3OH,等效为增大压强,反应前后气体的物质的量不变,与原平衡等效,平衡后CH3OH转化率不变,故D错误.
故选B.
点评 本题考查化学平衡常数的有关计算与影响因素、化学平衡移动、等效平衡、化学反应中能量变化等,难度中等,根据化学平衡常数进行计算、判断反应进行方向是考查的趋势.


科目:高中化学 来源: 题型:选择题
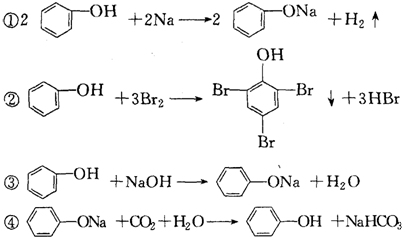
| A. | ①③ | B. | ②④ | C. | ② | D. | 都不可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
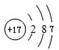 ,D微粒的结构示意图是
,D微粒的结构示意图是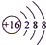 ,写出E的三种核素11H、21H、31H.
,写出E的三种核素11H、21H、31H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
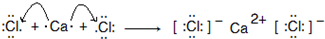 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O比Na2O2稳定 | B. | 均不可与水反应 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为Br.
;元素⑩名称为Br.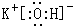 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
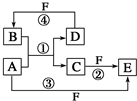 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).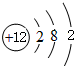 ,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 将1L0.1mol•L-1的Ba(OH)2溶液稀释为2L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com