
【题目】下列解释工业生产或应用的化学用语中,不正确的是
A. FeCl3溶液刻蚀铜电路板:2Fe3++Cu==2Fe2++Cu2+
B. Na2O2用作供氧剂:Na2O2+H2O==2NaOH +O2↑
C. 氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32![]() CaCO3(s)+SO42
CaCO3(s)+SO42
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是_______L
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是_______________mol,燃烧产物的平均摩尔质量是____________g/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如图所示的变化。
气体A![]()
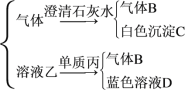
(1)写出下列物质的化学式:丙__,B___,C___,D___。
(2)写出甲跟乙反应的化学方程式:__。
(3)单质丙与溶液乙反应生成气体B的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是_______________。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________,σ键和π键数目之比为_____________。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________,中心离子的配位数为________________。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________。
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________。已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则该品体的晶胞参数a=_______pm(用含d和NA的代数式表示)。
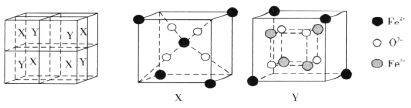
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。

①工业生产时一般会选用P4和1250℃进行合成,请解释其原因___________。
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向__________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中错误的是

A. 此过程中铁被腐蚀
B. 此过程中电子从Fe移向Cu
C. 正极电极反应式为:2H++2e-===H2↑
D. 此过程中还涉及反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据是
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏加德罗定律 | |
实 验 方 案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡, 试管中出现浑浊 | 测得ΔH为ΔH1、ΔH2的和 | H2与O2的体积比约为2︰1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A. NH4Cl的水解常数表达式:K=![]()
B. NaHCO3水解的离子方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
D. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com