
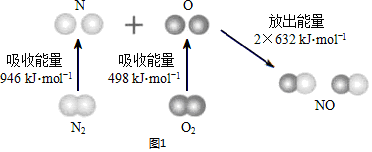

分析 Ⅰ.(1)①2NO(g)?N2(g)+O2(g),反应热等于生成物的键能-反应物的键能;
②如能自发进行,应满足△H-T•△S<0;
(2)1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol.在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,因反应前后体积不变,则平衡不移动,第30min时,保持温度和体积不变,向容器中再通入0.2molNO,NO物质的量增大,且平衡逆向移动,达到平衡时,各物质的含量不变,第50min时达到平衡,NO的物质的量应变为0.48mol;
Ⅱ.(1)FeO与NaNO3在加热条件下发生反应生成氧化铜和亚硝酸钠;
(2)用电解法降解NO2?其原理如图3所示,NO2?在阴极被还原生成氮气,则A为正极,B为负极.
解答 解:Ⅰ.(1)①2NO(g)?N2(g)+O2(g),反应热等于生成物的键能-反应物的键能,△H=(2×632kJ/mol)-(946kJ/mol+498kJ/mol)=-180kJ/mol,
故答案为:-180kJ/mol;
②该反应的△H<0,如能自发进行,应满足△H-T•△S<0,△S不确定,则若△S>0则反应一定自发;若△S<0则反应在低温下自发,
故答案为:该反应△H<0,若△S>0则反应一定自发;若△S<0则反应在低温下自发;
(2)1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol.在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,因反应前后体积不变,则平衡不移动,第30min时,保持温度和体积不变,向容器中再通入0.2molNO,NO物质的量增大,且平衡逆向移动,达到平衡时,各物质的含量不变,第50min时达到平衡,NO的物质的量应变为0.48mol,则图象为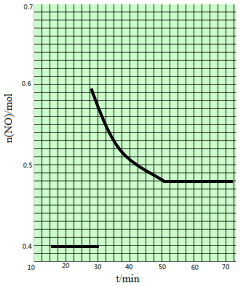 ,
,
故答案为: ;
;
Ⅱ.(1)FeO与NaNO3在加热条件下发生反应生成氧化铜和亚硝酸钠,方程式为2FeO+NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+NaNO2,
故答案为:2FeO+NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+NaNO2;
(2)用电解法降解NO2?其原理如图3所示,NO2?在阴极被还原生成氮气,则A为正极,B为负极,阴极发生2NO2-+6e-+4H2O=N2↑+8OH-,
故答案为:A; 2NO2-+6e-+4H2O=N2↑+8OH-.
点评 本题考查较为综合,涉及化学反应与能量变化,化学平衡以及电解等知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
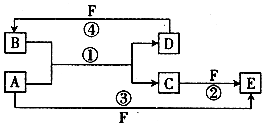 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出) ,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为(F为浓溶液)C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 1,3-二丁烯 | |
| B. | CH3COOCH2CH2OOCCH3 乙二酸二乙酯 | |
| C. | CH3CH2CH(OH)CH3 3-丁醇 | |
| D. |  2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol.L-1的氨水中NH4+、NH3和NH3•H2O的总数为NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L | |
| D. | 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| C. | 根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 | |
| D. | 强电解质溶液的导电能力一定强于弱电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2═2O3有单质参加,属于氧化还原反应 | |
| D. | 向水中加入明矾进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第2周期 | ① | ② | ||||||
| 第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 第4周期 | ⑨ | ⑩ |
 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com