
(18分)资料显示:“氨气可在纯氧中安静燃烧”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
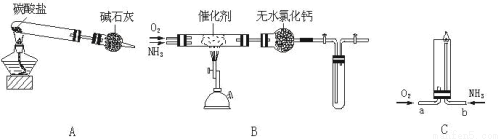
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是_____ ___________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该气体是__________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是 。
②氨气燃烧的化学方程式是 。
科目:高中化学 来源:2014-2015学年广东高考佛山市高三二模理综化学试卷(解析版) 题型:选择题
下列各组离子在水溶液能大量共存的是
A.Cu2+、K+、OH-、SO42- B.Na+、Ca2+、HCO3-、Cl-
C.NH4+、Al3+、AlO2-、H+ D.SO32-、Ba2+、H+、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是
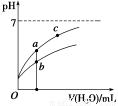
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.图像中a、c两点所处的溶液中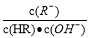 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:简答题
(14分)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X的单质只有氧化性.
(1)写出实验室制取W2反应的离子方程式 .
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质.

①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”) ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 .
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母) ,可以看到白色沉淀生成,其原因为 ______________________(写出其中一种即可).
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)若由元素Y和X组成—2价酸根Z,Z中Y和X的质量比为Y:X=4:3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生.写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式 .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.碳酸氢钾水【解析】
HCO3—+H2O 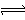 H3O++CO32—
H3O++CO32—
B.向硝酸银溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
C.浓度均为0.1mol·L-1的氢氧化钡溶液与碳酸氢铵溶液等体积混合Ba2++2OH-+NH4++ HCO3—=BaCO3↓+NH3·H2O+H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第七次模拟考试理综化学试卷(解析版) 题型:选择题
下列有关物质的说法正确的是
A.淀粉、纤维素、蛋白质的水解产物相同,都可以用来酿酒
B. 油脂水解产物之一的甘油与乙醇含有相同的官能团
C.乙醇与乙醛互为同分异构体,乙醇可由乙烯通过加成反应制取
D. 通过石油的裂化可得到乙烯,煤的干馏可得到煤焦油
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:实验题
(14分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
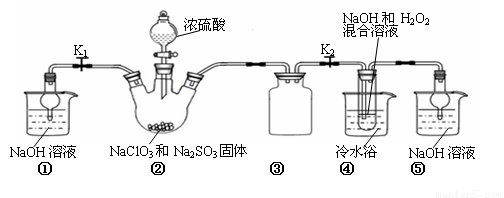
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c molL-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:选择题
对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成。下列关于化合物M和对乙烯基苯甲酸的说法正确的是

A.对乙烯基苯甲酸的分子式为C9H10O2
B.对乙烯基苯甲酸的同分异构体共有三种
C.对乙烯基苯甲酸即属于羧酸,又属于烯烃
D.二者均可发生取代反应和聚合反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:填空题
(A)(13分)在晶体中,微观粒子是有规律排布的。而实际上的晶体与理想结构或多或少会产生偏离,这种偏离称为晶体的缺陷。由于晶体缺陷,氧化铁FexO中的x常常不确定。
(1)请写出铁原子基态电子排布式 。
(2)Fe2+与Fe3+相比,较稳定的是 ,请从二者结构上加以解释 。
(3)硫氰根离子和异硫氰根离子都可用SCN-表示,碳原子都处于中央,则碳原子的轨道杂化类型为 。其中异硫氰根离子与CO2是等电子体,异硫氰根离子的电子式为 。Fe3+与SCN―可以形成配位数1~6的配离子,若Fe3+与SCN―以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为 。
(4)如图:铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是
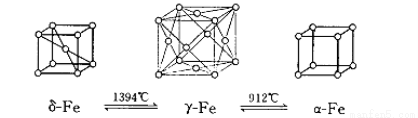
A.γ-Fe晶体中,铁原子的配位数为12
B.δ-Fe晶体和α-Fe晶体都是非密置在三维空间堆积而成的,堆积后非密置层都保持原来的结构不变
C.三种晶体的空间利用率大小为:γ-Fe晶体>δ-Fe晶体>α-Fe晶体
D.三种晶胞的棱长之比为: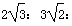 3
3
(5)FexO有NaCl结构的晶胞。今有某种FexO晶体中就存在如图所示的缺陷,其密度为5.71 g·cm-3,晶胞棱长为a=4.28×10-8cm(已知:4.283=78.4),则x= 。
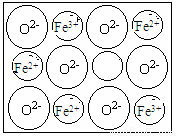
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com