
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.金属钠晶体中,Na的原子半径为acm,则其晶体密度为![]()
B.常温下醋酸铵溶液的pH=7,则0.1mol·L-1该溶液中c(CH3COO-)=c(NH![]() )=0.1mol·L-1
)=0.1mol·L-1
C.标准状况下,11.2L HF分子中F原子数为0.5NA
D.5.6g铁粉与稀硝酸反应,转移的电子数一定为0.3NA
【答案】A
【解析】
A.金属钠晶体为钾型,所以在晶胞中含有钠原子数为1+8×![]() =2,钠原子的半径为a cm,则体对角线为4a cm,设棱长为x,3x2=(4a)2,x=
=2,钠原子的半径为a cm,则体对角线为4a cm,设棱长为x,3x2=(4a)2,x=![]() cm,体积为
cm,体积为![]() cm3,则钠晶体的密度表达式是
cm3,则钠晶体的密度表达式是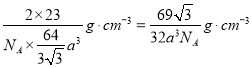 ,A正确;
,A正确;
B.常温下醋酸铵溶液的pH=7,则[H+]=[OH-],根据电荷守恒可知该溶液中c(CH3COO-)=c(NH![]() ),因铵根离子和醋酸根离子要发生水解,故c(CH3COO-)=c(NH
),因铵根离子和醋酸根离子要发生水解,故c(CH3COO-)=c(NH![]() )<0.1mol·L-1,B错误;
)<0.1mol·L-1,B错误;
C.标准状况下,HF为非气体状态,无法计算,C错误;
D. 5.6g铁为0.1mol,若稀硝酸过量,铁被氧化成铁离子,则失去0.3mol电子,若铁过量,铁被氧化成亚铁离子,则失去0.2mol电子,D错误;
答案选A。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】氮、砷(As)均为第ⅤA族元素。回答下列问题:
(1)元素周期表中,As位于第_____周期,基态As的价电子排布式为______。与As同周期,基态原子的核外电子排布式中有5个未成对电子的元素是______(写元素符号)。
(2)隔夜的叶菜类熟菜不能食用,原因是其中的部分![]() 在硝酸还原酶作用下转化为致癌的
在硝酸还原酶作用下转化为致癌的![]() 。
。![]() 中N原子的杂化方式为__________________,
中N原子的杂化方式为__________________,![]() 的空间构型是______。
的空间构型是______。
(3)氢氰酸(HCN)可用于制造剧毒的氢氰酸盐毒药,氢氰酸分子的结构式为__________________。
(4)立方氮化硼(BN)质地非常坚硬,是超硬材料,可制成高速切割工具和地质勘探、石油钻探的钻头,其晶胞结构如图所示(黑球为B原子):
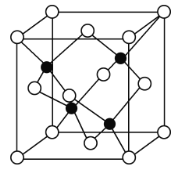
BN晶体中N原子的配位数是______。若阿伏加德罗常数的值为NA,该晶体的密度为ρ g.cm-3,则晶胞边长a=______nm(用含ρ和NA的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
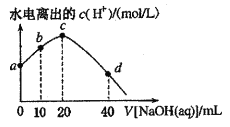
A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 0 mol·L-1NH4Cl溶液中逐滴加入0.100 0 mol·L-1KOH溶液时,溶液的pH与KOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
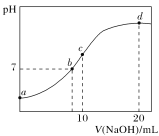
A.点a所示溶液中水的电离程度小于相同温度下纯水的电离程度
B.点b所示溶液中:c(NH4+)=c(K+)=c(H+)=c(OH-)
C.点d所示溶液中的溶质为一水合氨
D.点c所示溶液中:c(K+)+c(H+)=c(NH3·H2O)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如图所示。A包含物质为H2O和________(填化学式)。
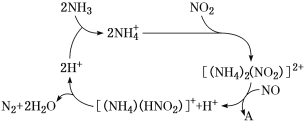
(2)已知:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH1=-a kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH2=-b kJ·mol-1
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的ΔH=________ kJ·mol-1。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) ΔH>0。
HCN(g)+3H2(g) ΔH>0。
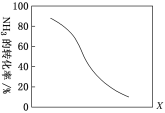
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是________(填字母)。
a.温度 b.压强 c.催化剂 d.![]()
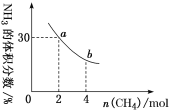
②在一定温度下,向2 L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如下图所示。a点时,CH4的转化率为_______%;平衡常数:K(a)____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为Mb(aq)+O2(g) ![]() MbO2(aq),该反应的平衡常数可表示为K=
MbO2(aq),该反应的平衡常数可表示为K=![]() 。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=
。在37 ℃条件下达到平衡时,测得肌红蛋白的结合度(α)与p(O2)的关系如图所示。[α=![]() ×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。
×100%]。研究表明正反应速率v正=k正·c(Mb)·p(O2),逆反应速率v逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。试求出图中c点时,上述反应的平衡常数K=________。已知k逆=60 s-1,则速率常数k正=________s-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列两个实验的说法正确的是( )
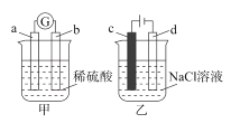
A.若甲中b电极的表面有气泡产生,则b为阳极
B.若甲中a为Zn,b为Cu,则正极附近的SO![]() 离子浓度逐渐增大
离子浓度逐渐增大
C.若乙中c电极为Fe,则电解一段时间后,溶液变浑浊
D.若乙中c、d均为惰性电极,产生22.4LCl2时,则转移电子2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+![]() O2(g)=H2O(g) △H=Q mol·L-1的反应过程中能量变化如下图,下列说法错误的是
O2(g)=H2O(g) △H=Q mol·L-1的反应过程中能量变化如下图,下列说法错误的是
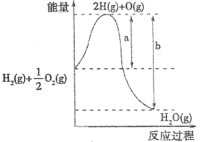
A.Q>0B.a代表该反应的活化能
C.b代表H2O(g)=H2(g)+![]() O2(g)的活化能D.a-b代表该反应的焓变
O2(g)的活化能D.a-b代表该反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水的电离平衡中,[H+]和[OH-]的关系如图所示:
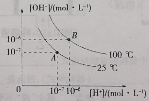
(1)A点水的离子积常数____(填“>”、“=”或“<”)B点水的离子积常数,造成水的离子积常数变化的原因是____。
(2)25℃时,若向水中滴加稀硫酸,___(填“能”或“不能”)使体系处于A点状态,原因是___。
(3)100℃时,若稀硫酸中由水电离产生的[H+]=1×10-8 mol·L-1,则稀硫酸的pH=_____,用pH试纸测定溶液的pH时,正确操作是____。
(4)100℃时将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液的体积之和),所得混合溶液的pH=2,则V1:V2=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是甲、乙、丙、丁四种有机物的有关信息:
甲 | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成丙; ③比例模型为 |
乙 | ①由C、H两种元素组成; ②比例模型为 |
丙 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与丁反应生成相对分子质量为100的酯 |
丁 | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)甲与溴的四氯化碳溶液反应的生成物的结构简式是__。
(2)乙具有的性质是__(填序号)。
A.无色无味液体,有毒
B.不溶于水,密度比水的大
C.不能使酸性KMnO4溶液褪色
D.任何条件下不与氢气反应
(3)丙的官能团的名称:__;写出丙与Na反应的化学方程式:__。
(4)甲与氢气发生加成反应后生成物质戊,与戊在结构上相似的有机物有一大类(即“同系物”),它们均符合通式CnH2n+2。当n≥__时,这类有机物出现同分异构现象。
(5)丙与丁反应能生成相对分子质量为100的酯,该反应的反应类型为__;其化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com