
| A、乙烷与氯气在光照条件下发生加成反应 |
| B、将石蜡油(液态烷烃混合物)加强热分解生成的气体都是烷烃 |
| C、甲苯能够使溴的四氯化碳溶液和酸性的高锰酸钾溶液褪色 |
| D、乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸 |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、1.8×10-7mol/L |
| B、1.8×10-8 mol/L |
| C、1.8×10-9mol/L |
| D、1.8×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 |
B、苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为 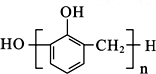 |
| C、醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 |
D、迷迭香酸的结构为 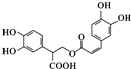 它可以发生酯化、水解、加成等反应 它可以发生酯化、水解、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
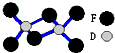 短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )
短周期元素A、B、C、D、E、F的原子序数依次增大,A与E、B与F属于同一主族,且A与E可以形成某种化合物X,其中A的质量分数为50%;C、D、F最高价氧化物对应的水化物两两之间都能反应,且C、D、F原子最外层电子数之和等于C的原子序数.则下列说法正确的是( )| A、D、F两种元素能形成如图所示的二聚分子,则该化合物的化学式是D2F6,为离子化合物,在熔融状态下能导电 |
| B、B、F两元素形成的氢化物稳定性中,B的氢化物比较稳定,其原因为其分子间存在氢键 |
| C、将标况下22.4L的X加入到足量的水中,完全吸收后得1mol的对应的酸 |
| D、用电解法可制得C、D、F的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加氮气的量能提高氢气的转化率 |
| B、升高温度有利于氨气的合成 |
| C、采用冷水降温的方法将合成混合气体中的氨气液化 |
| D、此法与哈伯法合成氨工艺相近 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某些金属化合物具有特定的颜色,因此可制作烟花 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
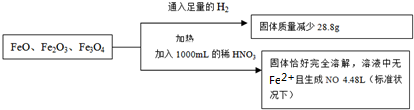
| A、3.8mol?L-1 |
| B、4.0mol?L-1 |
| C、4.4mol?L-1 |
| D、3.6mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com