
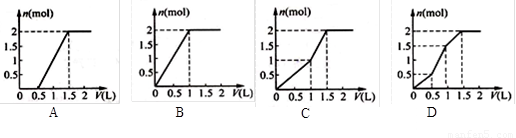
用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 moI·L-1 的Ba(OH)2 溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2 溶液体积(V)间的关系图正确的是
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:


| ||
| ||
 NH4++OH-
NH4++OH- NH4++OH-
NH4++OH-查看答案和解析>>
科目:高中化学 来源:2011年浙江省杭州市萧山区高考化学模拟试卷(十九)(解析版) 题型:填空题
 CO(g)+H2(g)△H=+131.3kJ?mol-1,
CO(g)+H2(g)△H=+131.3kJ?mol-1,| 化学键 | C-O | C-H | H-H | C≡O | O-H |
| 键能 kg/mol-1 | 358 | 413 | 436 | 1072 | 463 |
 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol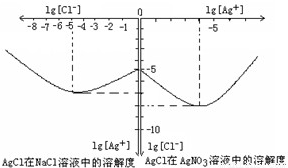
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com