
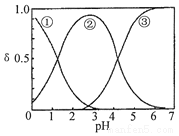
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)增大 |
分析 由图可知①代表的是H2C2O4、②代表的是HC2O4-③代表的是C2O42-,由此分析:
A、曲线①代表的粒子是H2C2O4;
B、由图可知,NaHC2O4溶液pH=3~4,证明溶液显示酸性,阴离子的电离程度大于其水解程度;
C、由图可知,pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4);
D、一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)?C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大.
解答 解:A、曲线①代表的粒子是H2C2O4,故A错误;
B、NaHC2O4溶液pH=4,证明溶液显示酸性,阴离子HC2O4-的电离程度大于其水解程度,所以c(H2C2O4)<c(C2O42-),故B正确;
C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),故C错误;
D、一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)?C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,故D正确;
故选BD.
点评 本题考查学生盐的水解原理的应用:离子浓度大小比较知识,注意知识的归纳和整理是关键,题目难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子是化学变化中最小的粒子 | |
| B. | 一切原子的原子核都是由质子、中子构成的 | |
| C. | 分子的质量总比原子质量大 | |
| D. | 分子、原子、离子都能直接构成物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 等体积、等浓度的HCOONa和NaCN两溶液中所含阴离子数目相等 | |
| B. | HCOO-、CN-、HS-在溶液中可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+C(S2-) | |
| D. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、Cu2+、NH4+、Cl- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用工业酒精配制饮用酒和调味用的料酒 | |
| B. | 食用白糖的主要成分是蔗糖 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 液化石油气的主要成分是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com