
 CO2(g)+H2(g)��H��0��CO��H2O�����ʵ���Ũ�ȱ仯��ͼ��ʾ����
CO2(g)+H2(g)��H��0��CO��H2O�����ʵ���Ũ�ȱ仯��ͼ��ʾ����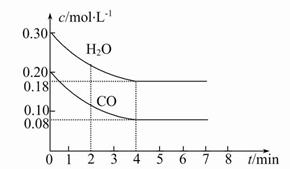
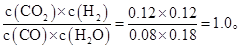 60% ��80%
60% ��80%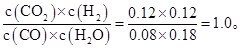


 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2O4,���в���˵����Ӧ�ﵽ��ƽ��״̬���� (����)
N2O4,���в���˵����Ӧ�ﵽ��ƽ��״̬���� (����)| A��N2O4����������N2O4�ֽ��������ʱ |
| B���������ƽ����Է����������ֲ���ʱ |
| C��NO2�ķ�������N2O4��������Ϊ2��1ʱ |
| D����ϵ��ɫ���ٷ����ı�ʱ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
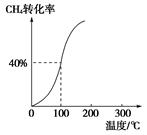
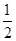 �������������䣬��ƽ����ϵ������Ӱ����________������ĸ��ţ���
�������������䣬��ƽ����ϵ������Ӱ����________������ĸ��ţ���| A��c��H2����С |
| B������Ӧ���ʼӿ죬�淴Ӧ���ʼ��� |
| C��CH3OH�����ʵ������� |
D������ƽ��ʱ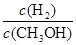 ��С ��С |
 CO��g����2H2��g�����˷�Ӧ���Է����е�ԭ���ǣ�___��
CO��g����2H2��g�����˷�Ӧ���Է����е�ԭ���ǣ�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
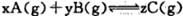 ƽ��ʱ���A��Ũ��Ϊ0. 5mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱA��Ũ�ȱ�Ϊ0. 3m ol/L�������й��ж���ȷ����
ƽ��ʱ���A��Ũ��Ϊ0. 5mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱA��Ũ�ȱ�Ϊ0. 3m ol/L�������й��ж���ȷ����| A��B��ת���ʽ��� |
| B��x+y<z |
| C��ƽ��������Ӧ�����ƶ� |
| D��C������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 N2(g)��2CO2(g)��H����746.8 kJ��mol��1���ں��ݵ��ܱ������У���Ӧ�ﵽƽ����ı�����һ������X��Y��X�ı仯������ͼ�����ߵ���( )
N2(g)��2CO2(g)��H����746.8 kJ��mol��1���ں��ݵ��ܱ������У���Ӧ�ﵽƽ����ı�����һ������X��Y��X�ı仯������ͼ�����ߵ���( )
| A����X��ʾ�¶�ʱ��Y��ʾƽ�ⳣ��K |
| B����X��ʾ�¶�ʱ��Y��ʾCO��ת���� |
| C����X��ʾN2�����ʵ���ʱ��Y��ʾNO��ת���� |
| D����X��ʾNO�����ʵ���ʱ��Y��ʾƽ�ⳣ��K |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 SO3(g)+NO(g)����H="-41.8" kJ��mol-1,���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6,����˵����ȷ����(����)
SO3(g)+NO(g)����H="-41.8" kJ��mol-1,���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6,����˵����ȷ����(����)| A��ƽ�ⳣ��K= |
| B���ﵽƽ���NO2��SO2��ת������� |
| C��SO3��NO������ȱ��ֲ������֤���ﵽƽ��״̬ |
| D���ڷ�Ӧ�����п��ܴ���c(NO2)=c(SO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
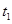 ʱ��ƽ�⣺
ʱ��ƽ�⣺ ʱ�̷ֱ�ı䷴Ӧ��һ�����������������C��g����Ũ����ʱ��仯��ͼ��ʾ���й�˵����ȷ����
ʱ�̷ֱ�ı䷴Ӧ��һ�����������������C��g����Ũ����ʱ��仯��ͼ��ʾ���й�˵����ȷ����
A��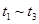 ��÷�Ӧ��ƽ�ⳣ����ͬ����Ϊ0��25 ��÷�Ӧ��ƽ�ⳣ����ͬ����Ϊ0��25 |
B��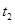 ʱ�̸ı��������ʹ�ô��� ʱ�̸ı��������ʹ�ô��� |
C��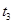 ʱ�̸ı����������ȥ����D ʱ�̸ı����������ȥ����D |
| D����Ӧ����ʽ��x=2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 TaI4��g��+S2��g�� ����
TaI4��g��+S2��g�� ����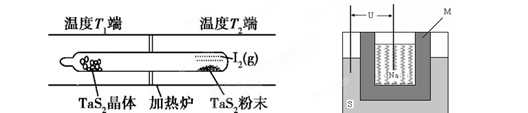
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com