
【题目】(15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
(1)Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .
(2)CO2和CH3OH分子中C原子的杂化形式分别为和 .
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.
【答案】
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2;O;Mn
(2)sp;sp3
(3)H2O>CH3OH>CO2>H2;常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高
(4)π键、离子键
(5)![]() ;
;![]()
【解析】解:(1)Co是27号元素,位于元素周期表第4周期第VIII族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2 . 元素Mn与O中,由于O元素是非金属性而Mn是过渡元素,所以第一电离能较大的是O,O基态原子价电子为2s22p4 , 所以其核外未成对电子数是2,而Mn基态原子价电子排布为3d54s2 , 所以其核外未成对电子数是5,因此核外未成对电子数较多的是Mn,
所以答案是:1s22s22p63s23p63d74s2或[Ar]3d74s2;O;Mn;(2)CO2和CH3OH的中心原子C原子的价层电子对数分别为2和4,所以CO2和CH3OH分子中C原子的杂化形式分别为sp和sp3 ,
所以答案是:sp;sp3;(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为H2O>CH3OH>CO2>H2 , 原因是常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高,
所以答案是:H2O>CH3OH>CO2>H2;常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高;(4)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个氧原子形成3个σ键,硝酸根中有一个氮氧双键,所以还存在π键,
所以答案是:π键、离子键;(5)因为O2﹣是面心立方最密堆积方式,面对角线是O2﹣半径的4倍,即4r= ![]() a,解得r=
a,解得r= ![]() nm;MnO也属于NaCl型结构,根据晶胞的结构,Mn2+构成的是体心立方堆积,体对角线是Mn2+半径的4倍,面上相邻的两个Mn2+距离是此晶胞的一半,因此有
nm;MnO也属于NaCl型结构,根据晶胞的结构,Mn2+构成的是体心立方堆积,体对角线是Mn2+半径的4倍,面上相邻的两个Mn2+距离是此晶胞的一半,因此有 ![]() nm,
nm,
所以答案是: ![]() ;
; ![]() .
.
【考点精析】本题主要考查了氢键的存在对物质性质的影响的相关知识点,需要掌握氢键主要存在于HF、H2O、NH3、CH3CH2OH分子间;故HF、H2O、NH3的沸点分别与同族氢化物沸点相比反常的高才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】一定温度下的密闭容器中发生反应2SO2 + O2 ![]() 2SO3,下列说法正确的是
2SO3,下列说法正确的是
A. 2 molSO2和1 molO2反应可生成2 molSO3
B. 向上述反应中再加入18O2,达平衡时,18O只存在于SO3中
C. 升高温度,只能加快2SO2+O2![]() 2SO3(g)反应的正反应速率
2SO3(g)反应的正反应速率
D. 选择适宜的催化剂能增大反应速率,提高生产效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放.
(1)SCR(选择性催化还原)工作原理:
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2 , 该反应的化学方程式: .
②反应器中NH3还原NO2的化学方程式: .
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4 , 使催化剂中毒.用化学方程式表示(NH4)2SO4的形成: .
④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60gmol﹣1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3 , 所得NH3用过量的v1 mL c1 molL﹣1H2SO4溶液吸收完全,剩余H2SO4用v2mL c2 molL﹣1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是 .
(2)NSR(NOx储存还原)工作原理:
NOx的储存和还原在不同时段交替进行,如图a所示.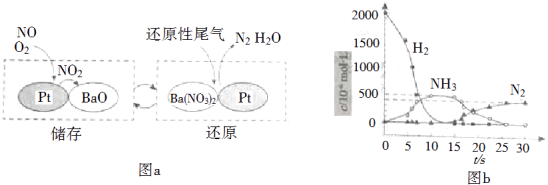
①通过BaO和Ba(NO3)2的相互转化实验NOx的储存和还原.储存NOx的物质是 .
②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系.第一步反应消耗的H2与Ba(NO3)2的物质的量之比是 .
③还原过程中,有时会产生笑气(N2O).用同位素示踪法研究发现笑气的产生与NO有关.在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO.将该反应的化学方程式补充完整: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.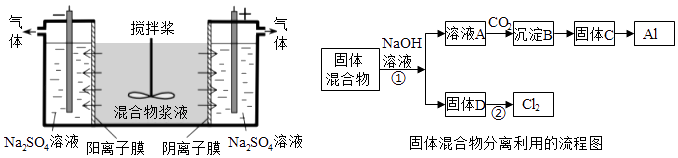
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 阳离子一定含有金属元素, 阴离子一定只含有非金属元素
B. 某金属元素的阳离子和某非金属元素的阴离子组成的物质一定是纯净物
C. 全部由非金属组成的化合物一定是共价化合物
D. 金属钾不可能从盐的水溶液中置换出金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为。
(2)X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。
(3)Y在周期表中的位置是 , 其含氧酸的化学式为。
(4)L与M形成的化合物中L的化合价是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于玻璃器皿上粘有的一些水洗不掉的残留物,其洗涤方法正确的是( )
①残留在试管内壁上的碘,用酒精洗涤
②盛放过苯酚的试剂瓶中残留的苯酚用酒精洗涤
③做银镜反应后试管壁上的银镜,用稀氨水洗涤
④黏附在试管壁上的油脂,用热碱液洗涤.
A.①③④
B.②③④
C.①②④
D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com