
【化学—选修2:化学与技术】粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为:SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
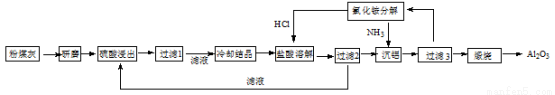
(1)粉煤灰研磨的目的是 。
(2)第1次过滤滤渣的主要成分有 和 (填化学式, 下同),第3次过滤时,滤渣的成分的是 。
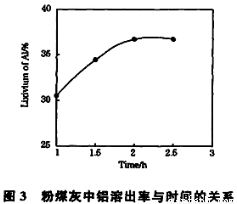
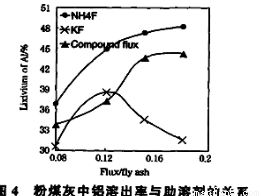
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如下图1,适宜的浸取时间为 h;铝的浸取率与“助溶剂/粉煤灰”的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及其NH4F与KF的混合物,在助溶剂/粉煤灰相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂缺点是 (举一例)。
(4)流程中循环使用的物质有 和 (填化学式)。
(5)用盐酸溶解硫酸铝晶体,能够发生的原因是 。
(6)用粉煤灰制取含铝化合物的主要意义是 。
科目:高中化学 来源:2015-2016学年江西吉安一中高一下第二次段考化学试卷(解析版) 题型:填空题
X、Y、Z、M、N为短周期的第五种主族元素。其中X、Z同主族,Y、Z同周期,M与X、Y既不同主族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表的位置是第 周期,第 族
(2)请写出下列反应的离子方程式:N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强的元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示) 。
(4)请将X、Z、M、N元素原子半径从大到小排序: (用元素符号表示)
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三最后一次模拟理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,则下列叙述正确的是
A.常温常压下,46g有机物C2H6O中含有C-H键的数目一定为6NA
B.同温同压下,5.6L NO和5.6LO2组成的混合气体中所含原子数为NA
C.1mol•L﹣1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl﹣的数目为3NA
D.1molCu与足量的S充分反应,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2016届安徽师大附中高三最后一卷理综化学试卷(解析版) 题型:填空题
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H= 。(请用含有△H1、△H2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
温度(K) | 平衡时NH3的物质的量(mol) |
T1 | 2.4 |
T2 | 2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
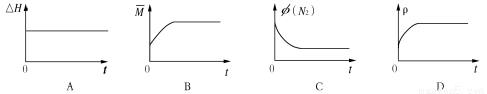
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
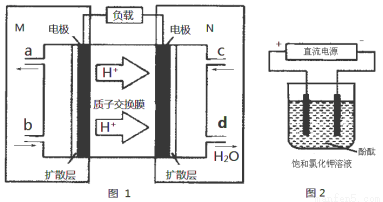
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定) ,若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
,若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三热身考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.物质A由Z与Y两种元素组成,则0.5mol物质A中含有的离子数约为9.03×1023
B.元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
C.元素Z、R的氧化物的水化物之间相互反应生成的盐溶液呈中性或碱性
D.元素Y、R分别与元素X形成的化合物的沸点:XmY<XmR
查看答案和解析>>
科目:高中化学 来源:2015-2016学年云南省高二下期中化学试卷(解析版) 题型:简答题
(1)锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH(难溶于水),回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是________,正极发生的主要反应式是 。
②用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,
加碱调节溶液pH,使溶液中氢氧根离子浓度达到 mol/L,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。继续加碱调节pH为 ,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
(2)在分析化学中常用Na2C2O4晶体(溶液无色)作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO+5C2O+16H+ 2Mn2+(溶液无色)+10CO2↑+8H2O。
2Mn2+(溶液无色)+10CO2↑+8H2O。
①若将W g Na2C2O4配成100 mL标准溶液,移取20.00 mL置于锥形瓶中,则酸性KMnO4溶液应装在__________(填“酸式”或“碱式”)滴定管中。本次滴定 选择指示剂(填“需要”、“不需要”)。判断滴定达终点的现象是____ ___。
②若滴定管起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为_ (填表达式)。

③若滴定完毕立即读数,测定的KMnO4溶液的浓度___(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
下图是产生和收集气体的实验装置示意图,该装置适合于

A.用H2O2溶液和MnO2制取O2
B.用浓盐酸和MnO2制取Cl2
C.用稀硝酸和Cu制取NO
D.用NH4C1和Ca(OH)2制取NH3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市高一6月学业调研化学试卷(解析版) 题型:选择题
下列物质分离方法不正确的是
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用分液的方法分离汽油和氯化钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com