
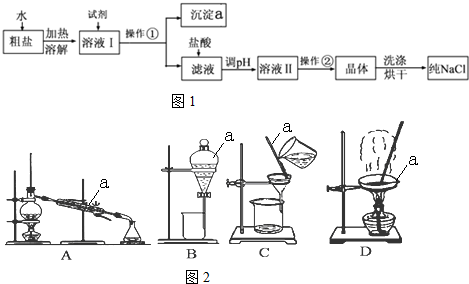
分析 (1)由流程可知,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,以此来解答;
(2))④中加碳酸钠可除去钡离子、钙离子,据此书写发生的离子反应;
(3)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(4)由于无480mL容量瓶,所以选择500mL容量瓶,配制出500mL溶液,根据m=cVM来计算;
(5)A.使用容量瓶前要检验容量瓶是否漏水;
B.容量瓶用蒸馏水洗净后,不能再用待配溶液润洗;
C.容量瓶不能作为溶解仪器使用;
D.用胶头滴管加蒸馏水到刻度线来定容;
E.容量瓶倒转和摇动多次来摇匀;
F.容量瓶不能储存溶液.
(6)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(7)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析对所配溶液浓度的影响.
解答 解:(1)由流程可知,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:用试管取少量第②步操作后的上层清液,再滴入几滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)④中加碳酸钠可除去钡离子、钙离子,发生离子反应为Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓,故答案为:Ca2++CO32-═CaCO3↓;Ba2++CO32-═BaCO3↓.
(3)没有480mL容量瓶,所以选择500mL容量瓶,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的玻璃仪器有烧杯、玻璃棒、500ml的容量瓶、胶头滴管,故还需的仪器有:500ml的容量瓶;
故答案为:500ml的容量瓶;
(4)由于无480mL容量瓶,所以选择500mL容量瓶,配制出500mL溶液,故所需的氯化钠的质量m=cVM=0.1mol/L×0.5L×58.5g/mol=2.9g,故答案为:2.9;
(5)A.使用容量瓶前要检验容量瓶是否漏水,故正确;
B.容量瓶用蒸馏水洗净后,不能再用待配溶液润洗,否则结果偏大,故错误;
C.准确称量好固体,把称好的试样在烧杯中加少量水溶解,容量瓶不能作为溶解仪器使用,故错误;
D.用玻璃棒引流向容量瓶中缓慢加入蒸馏水到接近刻度线2~3cm处,用胶头滴管加蒸馏水到刻度线,故正确;
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次来摇匀,故正确;
F.将配好的溶液转移到贴好标签的试剂瓶中,容量瓶不能储存溶液,故正确;
故选ADEF;
(6)容量瓶作为精密仪器不可用于储存和加热溶解固体、稀释液体,也不能测量除其规格以外容积的液体体积,容量瓶不能储存溶液.
故答案为:B;
(7)A.定容时俯视刻度线,会导致体积偏小,所以浓度偏大;
B.所用的NaCl中混有少量的泥沙,会导致浓度偏小;
C.转移完溶液后未洗涤玻璃棒和烧杯,会导致溶质减少,浓度偏小;
D.定容时加水超过刻度线,用胶头滴管吸出上层液体使液体凹液面与刻度相切,会吸出溶质,所以,浓度偏小;
E.配制溶液所用的容量瓶洗涤后没有烘干不影响实验,故答案为:A;BCD;E.
点评 本题考查物质分离、提纯实验方案的设计、一定物质的量浓度溶液知识,明确配制原理、把握粗盐提纯流程中的分离方法及发生的离子反应为解答的关键,侧重分析能力及物质除杂的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质所含离子 | SO42- | M | Mg2+ | Fe2+ |
| 物质的量浓度 | c | 3 | 3 | 2 |
| A. | 若M是NO3-,则c为3.5 | |
| B. | 若使Fe2+浓度降低,可以加入试剂NaOH | |
| C. | 若M是NH4+,则配制溶液所用的溶质不一定是3种 | |
| D. | 若加入BaCl2溶液能产生两种沉淀,则M可能是CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
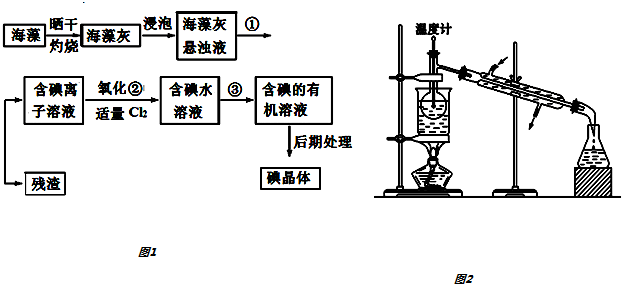
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 将制得的晶体转移到新制过滤器中用大量水进行洗涤 | |
| D. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
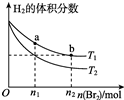 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A. | 由图可知:T1<T2 | |
| B. | a、b两点的正反应速率:b>a | |
| C. | 为了提高Br2(g)的转化率,可在其他条件不变时,将体积变为V/2 L | |
| D. | T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料的脱硫脱硝技术可以减少SO2、NOx的排放 | |
| B. | PM2.5是直径≤2.5微米的细颗粒物,其表面积大,易附带有毒有害物质 | |
| C. | O3能消毒杀菌,空气中O3浓度越大越有利于人体健康 | |
| D. | 汽车尾气中的CO主要来自汽油的不完全燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com