
乙酸是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指现将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5O SO3H),再水解生成乙醇,写出相应反应的化学方程式__________________________________。
SO3H),再水解生成乙醇,写出相应反应的化学方程式__________________________________。
(2)已知:
甲醇脱水反应 2CH3OH(g)==CH3OCH3(g)+ H2O (g) 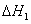 =
=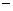 23.9 KJ﹒mol-1
23.9 KJ﹒mol-1
甲醇制烯烃反应 2CH3OH(g)== C2H4(g)+ 2H2O (g) 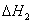 =
=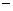 29.1 KJ﹒mol-1
29.1 KJ﹒mol-1
乙醇异构化反应 C2H5OH (g) ==CH3OCH3(g)
(g) ==CH3OCH3(g) 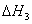 =+50.7KJ﹒mol-1
=+50.7KJ﹒mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)==C2H5OH(g)的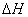 =______KJ﹒mol-1。与间接水合法相比,气相直接水合法的优点是____________________________________。
=______KJ﹒mol-1。与间接水合法相比,气相直接水合法的优点是____________________________________。
(3)下图为气相直接水合法乙烯的平衡转化率与温度、压强的关系(其中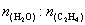 =1:1)
=1:1)
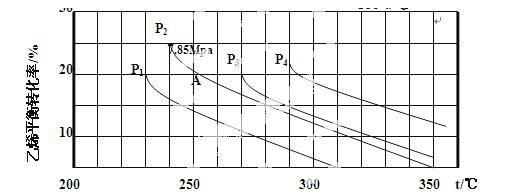
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(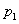 、
、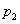 、
、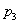 、
、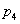 )的大小顺序为_________,理由是_________。
)的大小顺序为_________,理由是_________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,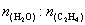 =0.6:1,乙烯的转化率为5%,若要进一步提高转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________、_________。
=0.6:1,乙烯的转化率为5%,若要进一步提高转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_________、_________。
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列关于有机物的说法正确的是
A.纯净物C4H8的核磁共振氢谱峰最多为4
B.化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色
C.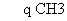 -O-
-O- 的同分异构体中,可以有醇、酚类物质
的同分异构体中,可以有醇、酚类物质
D.1 mol Br- -OOCCH2Br最多能与2 mol NaOH反应
-OOCCH2Br最多能与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
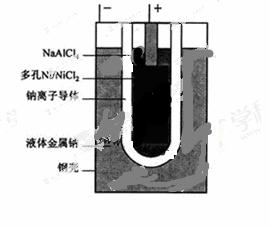
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还 原三价铝离子
原三价铝离子
C.正极反应为:NiCl2+2e-=Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,下列说法不正确的是( )。
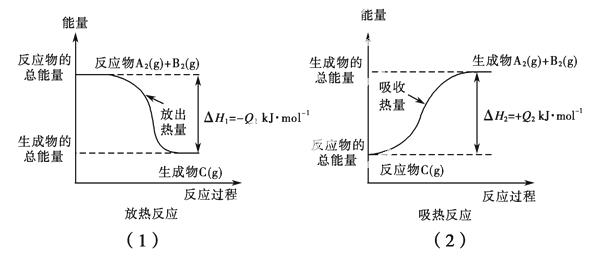
A.反应过程(1)的热化学方程式为A2(g)+B2(g)===C(g) ΔH1=-Q1kJ·mol-1
B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g) ΔH2=+Q2 kJ·mol-1
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
A、H2O(g)==H2(g)+1/2O2( g) △H =—485KJ/mol
g) △H =—485KJ/mol
B、H2O(g)==H2(g)+1/2O2(g) △H = + 485KJ/mol
C、2 H2(g) + O2(g)==2 H2O(g) △H = + 485KJ/mol
D、2 H2(g) + O2(g)==2 H2O(g) △H =—485KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是人们开发和利用的一种新能 源。已知:
源。已知:
①2H2(g)+O2(g)===2H2O(l)
ΔH1=-571.8 kJ·mol-1;
②CH3O H(g)+1/2O2(g)===CO2(g)+2H2(g)
H(g)+1/2O2(g)===CO2(g)+2H2(g)
ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热 化学方程式为______________________________________。
化学方程式为______________________________________。
(2)反应②中的能量变化如图所示,则ΔH2=________。
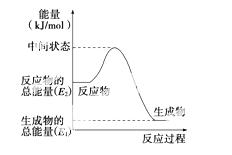
(3)H2(g)的燃烧热为________。
(4)请你分 析H2(g)作为能源比甲醇蒸气作为能源的优点:
析H2(g)作为能源比甲醇蒸气作为能源的优点:
__________________________________________________
__________________________________________________(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W代表短周期的四种元素,有关它们的部分结构及性质信息如下表所示。
| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的电子式是________________________,Z元素在周期表中的位置是________。
(2)X、Y、Z三元素的最高价氧化物对应水化物的酸性由强到弱的顺序是__________________________________________________。
(3)常温时,W的硫酸盐溶液的pH________7(填“<”、“>”或“=”),理由是__________________________________________________________
_____________________________________________ (用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)______________________________________________。
(5)25 ℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1 780.6 kJ的热量,写出该反应的热化学方程式:_______
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O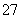 ,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一。该法用Fe作电极电解含Cr2O
,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一。该法用Fe作电极电解含Cr2O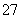 的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。下列有关说法不正确的是( )
的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。下列有关说法不正确的是( )
A.电解时选用Fe作阳极,石墨棒作阴极
B.阴极附近的沉淀只有Cr(OH)3
C.阳极附近溶液中,发生反应的离子方程式是Cr2O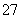 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.消耗1 mol Cr2O ,将有336 g Fe消耗,因此要定期更换铁电极
,将有336 g Fe消耗,因此要定期更换铁电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com