
��1��Ŀǰ���ʿռ�վ����CO2��һ����Ҫ�����ǽ�CO2��ԭ�����漰�ķ�Ӧ����ʽΪ��CO2��g��+4H2��g��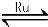 CH4��g��+2H2O��g�� ��H��0
CH4��g��+2H2O��g�� ��H��0
�������¶�ƽ����ϵ��H2�����������___________����ѡ���������С�����䡱��
��2����ͬ�¶�ʱ��������Ӧ�ڲ�ͬ��ʼŨ���·ֱ�ﵽƽ�⣬�����ʵ�ƽ��Ũ�����±���
[CO2]/mol��L-1 | [H2]/mol��L-1 | [CH4]/mol��L-1 | [H2O]/mol��L-1 | |
ƽ��� | a | b | c | d |
ƽ��� | m | n | x | y |
a��b��c��d��m��n��x��y֮��Ĺ�ϵʽΪ_________��
��3������ѪҺ�е�̼���̼�����δ���ƽ�⣺H++ HCO3- H2CO3�������������Ի�������ʽ���ѪҺ��ʱ��ѪҺ��pH�仯������ƽ���ƶ�ԭ��������������____________________
H2CO3�������������Ի�������ʽ���ѪҺ��ʱ��ѪҺ��pH�仯������ƽ���ƶ�ԭ��������������____________________
��4���������ϻ�֪������Ϣ��
i��H2CO3��Ki1=4.3��10-7��Ki2=5.6��10-11����Ki1����
ii������£�CO2���ܽ��ΪԼΪ1:1
iii��H2O+CO2  H2CO3
H2CO3 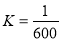
iv. 

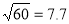 �S��6��=0.8
�S��6��=0.8
�볢�Թ��㣺
�ٱ��Ͷ�����̼��Һ��̼������ʵ���Ũ��c(H2CO3)ԼΪ_______________mol/L��
�ڱ��Ͷ�����̼��Һ��̼��ĵ���Ȧ�ԼΪ_____________��
��������ˮ��pHԼΪ____________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ����У��һ����������ѧ������ʦ�棩 ���ͣ�ѡ����
����˵����ȷ���ǣ� ��
A��1Lˮ���ܽ���58.5gNaCl������Һ�����ʵ���Ũ��Ϊ1mol/L
B����1L 2mol/L��H2SO4��Һ��ȡ��0.5L������Һ��Ũ��Ϊ1mol/L
C������500mL 0.1mol/L��CuSO4��Һ����8.0g����ͭ����
D��0.1mol/L MgCl2��Һ��Cl-Ũ��Ϊ0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������ʡ�����гǽ����ص��������һ�����л�ѧ���������棩 ���ͣ�ѡ����
�����и������ʰ��ᡢ��η���˳�����У�������ȷ���ǣ� ��
A������ ���� ��ȸʯ[Cu2��OH��2CO3] B������ �ռ� �̷�[FeSO4•7H2O]
C������ �Ҵ� ̼��� D������ ��ʯ�� ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��е���У��һ����������ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�д�����������Ũ�ȵ��������ӣ�0.4mol/L Cl����0.8mol/L SO42����0.2mol/L A l3+��0.6mol/L H+��M����M�������ʵ���Ũ�ȿ���Ϊ( )
l3+��0.6mol/L H+��M����M�������ʵ���Ũ�ȿ���Ϊ( )
A��Na+0.6mol/L B��CO32�� 0.2 mol/L
C��Mg2+0.4 mol/L D��Ba2+0.4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��е���У��һ����������ѧ�Ծ��������棩 ���ͣ�ѡ����
�ס��ҡ����������ֽ�������������Ȼ����Ҫ������̬���ڣ����ε�ˮ��Һ�����ö��� ������ʢ�ţ��������ε�ˮ��Һ����Ӧ���������ֽ����Ļ����ǿ������˳�������( )
������ʢ�ţ��������ε�ˮ��Һ����Ӧ���������ֽ����Ļ����ǿ������˳�������( )
A�����ұ��� B�����ұ��� C�����Ҷ��� D���Ҷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͬ�¶��£������Ϊ0.25 L�����������ܱ������з������淴Ӧ��
N2(g)��3H2(g) 2NH3(g) ��H����92.6 kJ��mol��1��
2NH3(g) ��H����92.6 kJ��mol��1��
ʵ������ʼ��ƽ��ʱ���й��������±���ʾ��
���� ��� | ��ʼʱ�����ʵ����ʵ���/mo | ��ƽ��ʱ��ϵ�����ı仯 | ||
N2 | H2 | NH3 | ||
�� | 1 | 3 | 0 | �ų�������23.15 kJ |
�� | 0.9 | 2.7 | 0.2 | �ų�������Q |
���������������
A�������١����з�Ӧ��ƽ�ⳣ�����
B���������д�ƽ��ʱ�ų�������Q��23.15 kJ
C���������ٵ����Ϊ0.5 L����ƽ��ʱ�ų�������С��23.15 kJ
D��ƽ��ʱ������������NH3������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��BaO2�����ܱյ���������У���Ӧ2BaO2(s) 2BaO(s)+O2(g)�ﵽƽ�⡣�����¶Ȳ��䣬��С�����ݻ�����ϵ���´ﵽƽ�⣬����˵����ȷ����( )
2BaO(s)+O2(g)�ﵽƽ�⡣�����¶Ȳ��䣬��С�����ݻ�����ϵ���´ﵽƽ�⣬����˵����ȷ����( )
A��ƽ�ⳣ����С B��BaO������ C�������ܶ����� D������ѹǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�˲��и�һ�����л�ѧ���������棩 ���ͣ�ѡ����
��0��5 LijŨ�ȵ�NaCl��Һ�к���0��5mol Na��������Һ��˵������ȷ����
A������Һ�����ʵ���Ũ��Ϊ1 mol��L��1
B������100 mL����Һ����5��85 g NaCl
C��0��5 L����Һ����58��5g NaCl
D����ȡ100 mL����Һ�����ձ��У��ձ���Na�������ʵ���Ϊ0��1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�����и�һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
��ѧ�����ڻ�ѧ��ռ����Ҫ��λ����ش��������⡣
��1�� 0.3molNH3����������ԭ������ ��H2O����������ԭ������ȡ�
��2����0.4mol Al3+��Al2��SO4�� 3��������SO42-�����ʵ����� ��
��3����֪16gA��20gBǡ����ȫ��Ӧ����0.04molC��31.76gD����C��Ħ������Ϊ ��
��4����һ�����¶Ⱥ�ѹǿ�£�1�������X2��3�������Y2��������2����������û�����Ļ�ѧʽ�� ��
��5��ij�λ����Һ�к������ӣ�Na+��Mg2+��Cl-��SO42-�����Na+��Mg2+��CI-�����ʵ���Ũ������Ϊ��0.2moI��L-l��0.25mol��L-l��0.4mol��L-l����c ��S O42-��= ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com